
| A. | 金属钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | Ag2S沉淀溶解电离方程式:Ag2S(s)?2Ag+(aq)+S2-(aq) | |
| C. | Fe3O4与稀硝酸溶液反应:Fe3O4+8H+═2Fe3++Fe2++4H2O | |
| D. | NaHCO3溶液与足量Ba(OH)2溶液混合:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
分析 A.离子方程式两边正电荷不相等,不满足电荷守恒;
B.硫化银为难溶物,在溶液中存在溶解平衡;
C.稀硝酸能够将亚铁离子氧化成铁离子;
D.氢氧化钡质量,碳酸氢根离子完全转化成碳酸钡沉淀,不会剩余碳酸根离子.
解答 解:A.金属钠与水反应生成氢氧化钠和氢气,正确的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,故A错误;
B.Ag2S在溶液中存在溶解平衡,其沉淀溶解电离方程式为:Ag2S(s)?2Ag+(aq)+S2-(aq),故B正确;
C.Fe3O4与稀硝酸溶液反应生成硝酸铁、一氧化氮气体和水,正确的离子方程式为:3Fe3O4+28H++NO3-=NO↑+9Fe3++14H2O,故C错误;
D.碳酸氢钠溶液与足量Ba(OH)2溶液混合,反应生成碳酸钡沉淀、氢氧化钠和水,正确的离子方程式为:HCO3-+Ba2++OH-═BaCO3↓+H2O,故D错误;
故选B.
点评 本题考查了离子方程式的正误判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,如:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等),C为易错点,注意反应生成铁离子.


科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol•L-1 | B. | 0.3 mol•L-1 | C. | 0.02 mol•L-1 | D. | 0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
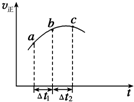 向绝热恒容密闭容器中通入SO2和NO2一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示,由图可得出的正确结论是( )
向绝热恒容密闭容器中通入SO2和NO2一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示,由图可得出的正确结论是( )| A. | △t1=△t2时,SO2的转化率:a~b段小于b~c段 | |
| B. | 反应物的总能量低于生成物的总能量 | |
| C. | 反应物浓度:a点小于b点 | |
| D. | 反应在C点达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白:
A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白: NH3•H2O+H+.
NH3•H2O+H+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液态氟化氢中存在氢键,所以其分子比氯化氢更稳定 | |
| B. | 由碳、氮原子形成的化合物比金刚石硬,其主要原因是碳氮键比碳碳键更短 | |
| C. | S8和NO2都是共价化合物,NH4Cl和CaC2都是离子化合物 | |
| D. | 若ⅡA某元素的原子序数为m,则同周期ⅢA元素的原子序数有可能为m+10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH3 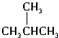 CH3CH2CH2CH2CH3 CH3CH2CH2CH2CH3 | |
| B. | CH3-CH3 CH2=CH-CH3 CH3CH=CHCH3 | |
| C. | 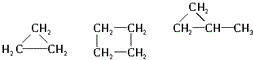 | |
| D. | CH3CH2CH2CH2CH3 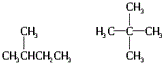 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实 验 操 作 | 现 象 | 实 验 结 论 | |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液 | 有白色沉淀生成 | 溶液中一定含有SO42- |
| B | 将某气体通入澄清石灰水中 | 变浑浊 | 该气体一定是CO2 |
| C | 向某溶液中加入2滴KSCN溶液; | 溶液不显红色; | 溶液中一定含有Fe2+ |
| 另取样,先滴入氯水,再滴入KSCN溶液 | 溶液变为红色 | ||
| D | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com