
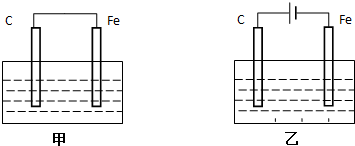
分析 (1)①甲为原电池装置,铁作负极,则石墨作正极,正极上氧气得电子;
②乙为电解装置,由电子流向可知石墨为阳极,阳极上氯离子放电,阴极上氢离子放电;
③Cl2氧化了生成的I2,Cl元素的化合价降低,由电子守恒及Cl2和I2的物质的量之比为5:1来判断反应后I元素的化合价,以此来书写化学反应;
(2)①甲为原电池装置,铁作负极,铁失电子;
②根据电解硫酸铜的化学反应及元素守恒来判断加入的物质使溶液恢复到电解前的状态,再由溶液的pH的变化计算加入物质的质量.
解答 解:(1)①甲为原电池装置,石墨棒上氧气得电子发生还原反应,反应为2H2O+O2+4e-═4OH-,
故答案为:2H2O+O2+4e-═4OH-;
②乙为电解装置,由电源可知C棒为阳极,阳极上氯离子放电,即2Cl--2e-=Cl2↑,阴极上氢离子放电,则电解反应为2Cl-+2H2O $\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-,故答案为:2Cl--2e-=Cl2↑;2Cl-+2H2O $\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-;
③Cl2氧化了生成的I2,Cl元素的化合价降低,生成盐酸,反应中Cl2和I2的物质的量之比为5:1,设I元素的化合价为x,则5×2×1=1×2×x,解得x=+5,则生成碘酸,所以发生的化学反应为5Cl2+I2+6H2O═10HCl+2HIO3,
故答案为:5Cl2+I2+6H2O═10HCl+2HIO3;
(2)①甲为原电池装置,铁作负极,负极反应为Fe-2e-═Fe2+,故答案为:Fe-2e-═Fe2+;
②由2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,要使溶液恢复原状态,可加入CuO(或CuCO3),一段时间后溶液的pH变为1,则c(H+)=0.1mol/L-10-5mol/L=0.1mol/L,n(H+)=0.2L×0.1mol/L=0.02mol,则由电解反应可知析出的Cu的物质的量为0.01mol,由Cu原子守恒可知,m(CuO)=0.01mol×80g/mol=0.8g,或m(CuCO3)=0.01mol×124g/mol=1.24g,
故答案为:CuO(或CuCO3);0.8(或1.24).
点评 本题考查原电池与电解池的工作原理,明确离子放电顺序、电极反应式的书写即可解答,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 甲烷 | B. | 石墨 | C. | 晶体硅 | D. | 水晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:NH3>AsH3>PH3 | B. | 熔点:Cs>Li>Na | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硅的提纯与应用,促进了半导体元件与集成芯片的发展 | |
| B. | 水泥、玻璃、塑料都是高分子材料 | |
| C. | 钢化玻璃与普通玻璃的主要成分不同 | |
| D. | 通常情况下,铝合金在空气中不易被腐蚀,可用做建筑材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
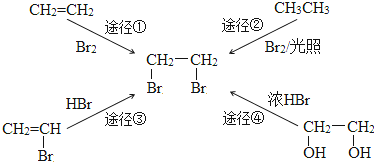
| A. | 途径① | B. | 途径② | C. | 途径③ | D. | 途径④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图所示,是原电池的装置图.请回答:
如图所示,是原电池的装置图.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com