
 ,故答案为:非极性;离子;
,故答案为:非极性;离子; ;
;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、C1=2C2 |
| B、C1>2C2 |
| C、C1<2C2 |
| D、C1=a |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是氢氧燃料电池构造示意图,电解质用的是30%的KOH溶液.关于该电池的说法不正确的是( )
如图是氢氧燃料电池构造示意图,电解质用的是30%的KOH溶液.关于该电池的说法不正确的是( )| A、a极是负极 |
| B、电子由b通过灯泡流向a |
| C、氢氧燃料电池是环保电池 |
| D、正极的电极反应是:O2+2H2O+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增加A的量,平衡向正反应方向移动 |
| B、升高温度,平衡向逆反应方向移动,v(正)增大 |
| C、压强增大一倍,平衡不移动,v(正)、v(逆)增大 |
| D、加入催化剂,B的转化率提高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
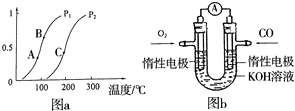 开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,可制作燃料电池.
开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,可制作燃料电池.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)已知2Cu(s)+
(1)已知2Cu(s)+| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com