
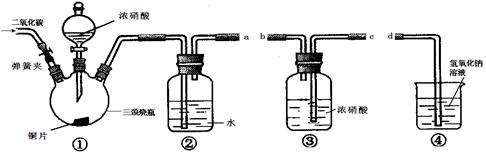


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源:不详 题型:实验题
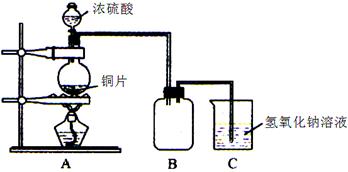
| 方案序号 | 分析 | 误差(偏低或偏高) | 改变措施 |
| | | | |
| | | | |
| | | | |
| | | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.滴定后读取标准液体积时仰视 |
| B.锥形瓶用蒸馏水洗后,未干燥 |
| C.碱式滴定管用蒸馏水洗后,未用标准液润洗 |
| D.滴定至溶液呈浅红色后,未等到半分钟立即开始读数 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2、O2、HCl | B.O2、NO2、NO | C.O2、NH3、H2 | D.CO2、O2、NH3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
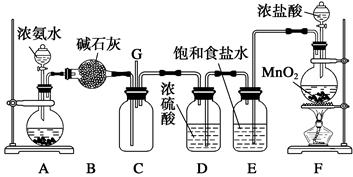
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.制备乙炔:实验室不能用启普发生器来制取乙炔 |
| B.制备乙酸乙酯:将乙醇和乙酸混合,再加入稀硫酸共热 |
| C.制备一氯乙烷:将乙烷和氯气的混合气放在光照条件下反应 |
| D.制备乙烯:实验室用无水乙醇和浓硫酸共热到170℃制取乙烯 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
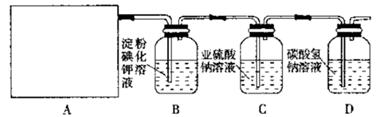
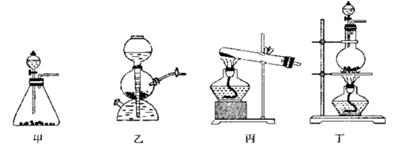
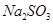 已被氧化(简述实验步骤):
已被氧化(简述实验步骤): 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com