
【题目】卤素及其化合物在生活、生产等领域有广泛应用。
(1)从海带等富含碘的物质中提取碘的工艺步骤之一为:在稀硫酸酸化作用下.用二氧化锰氧化I-,其离子方程式为____,该反应的还原产物为______(填化学式).
(2)从海水中提取溴的过程是:向酸化的海水中通入氯气![]() 富集溴
富集溴![]() 氧化溴
氧化溴![]() 提纯溴。
提纯溴。
已知部分信息(其中a>0,b>0);
Ⅰ.H2(g)+Cl2(g)=2HCl(g)ΔH=-akJ/mol
Ⅱ.H2(g)+Br2(g)=2HBr(g)ΔH2=-bkJ/mol
Ⅲ.几种化学键的键能数据如表所示:
化学键 | H-Br | H-Cl | Cl-Cl | Br-Br |
键能/(KJ/mol) | 366 | 432 | 243 | 194 |
①酸化海水的目的是_______
②比较大小:a_____b(填“>”、“=”或“<”)
③计算2HBr(g)+Cl2(g)=2HCl(g)+Br2(g)ΔH=_____kJ/mol(填具体数值)=_____kJ/mol (填含a,b的代数式)
(3)298K,取一定量的含Br-、Cl-的浓缩溶液。滴加稀硝酸银溶液。当生成浅黄色沉定时存在平衡: AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq),该反应的化学平衡常数为_______已知:[Ksp(AgCl)=1.54×10-10、Ksp(AgBr)=7.7×10-13]。
AgBr(s)+Cl-(aq),该反应的化学平衡常数为_______已知:[Ksp(AgCl)=1.54×10-10、Ksp(AgBr)=7.7×10-13]。
(4)常温下Fe3+和I-在水中的反应为2Fe3+(aq)+2I-(aq)![]() 2Fe2+(aq)+I2(aq)(不考虑离子水解)。下列情况能说明该反应达到平衡状态的是_____(填字母)
2Fe2+(aq)+I2(aq)(不考虑离子水解)。下列情况能说明该反应达到平衡状态的是_____(填字母)
A.Fe3+的消耗速率率等于Fe2+的生成速率
B.溶液的颜色保持不再变化
C.2v(I-)逆=v(I2)正
D.溶液中的c(Fe3+)=c(I-)
E.溶液中的![]() 保持不再变化
保持不再变化
(5)CuBr2是一种重要的化工原料,在密闭容器中投入足量的CuBr(s),在一定温度下发生反应:2CuBr2(s)![]() 2CuBr(s)+Br2(g)反应达到平衡时,c(Br2)=10mol/L。如果温度保持不变,将容器体积用缩至原来的一。则平衡时c(Br2)的浓度(mol/L)可能为____mol/L (填字母)。
2CuBr(s)+Br2(g)反应达到平衡时,c(Br2)=10mol/L。如果温度保持不变,将容器体积用缩至原来的一。则平衡时c(Br2)的浓度(mol/L)可能为____mol/L (填字母)。
A.0.5 b.1.0 c.3.0 d.4.0
【答案】MnO2+2I-+4H+=Mn2++I2+2H2O Mn2+(或MnSO4) 抑制氯气与水反应 > -83 (b-a) 200 BE b
【解析】
用二氧化锰可以氧化I-为I2,其离子方程式为MnO2+2I-+4H+=Mn2++I2+2H2O,该反应的还原产物为. MnSO4。
①因为Cl2+H2O=HCl+HClO,加酸酸化,使平衡逆向移动,降低了氯气溶解。所以①酸化海水的目的是抑制氯气与水反应。
②由Ⅰ.H2(g)+Cl2(g)=2HCl(g)ΔH=-akJ/mol, Ⅱ.H2(g)+Br2(g)=2HBr(g)ΔH2=-bkJ/mol
I-II得:Cl2(g)+ 2HBr(g)= 2HCl(g)+ Br2(g) ΔH=-(a-b) kJ/mol
-(a-b)=243 KJ/mol+2![]() -2
-2![]() -194 KJ/mol=-83 KJ/mol,所以a>b,答案:>。
-194 KJ/mol=-83 KJ/mol,所以a>b,答案:>。
③由上述分析知2HBr(g)+Cl2(g)=2HCl(g)+Br2(g)ΔH=--83kJ/mol=-(a-b )kJ/mol
(3)由:AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq) 反应的化学平衡常数K=
AgBr(s)+Cl-(aq) 反应的化学平衡常数K=![]() = Ksp(AgCl)/ Ksp(AgBr)=( 1.54×10-10)/( 7.7×10-13)= 200.答案:200。
= Ksp(AgCl)/ Ksp(AgBr)=( 1.54×10-10)/( 7.7×10-13)= 200.答案:200。
(4)A.Fe3+的消耗速率率等于Fe2+的生成速率只能说反应正向进行,不能作为判断平衡的标志,故A错;B.溶液的颜色保持不再变化说明c(Fe3+)和c(Fe2+)不变,反应达到平衡,故B正确;C如果2(aq)+2I-(aq)![]() 2Fe2+(aq)+I2(aq) 达到平衡,v(I-)逆=2v(I2)正,故C错;D.溶液中的各离子浓度保持不变,不是c(Fe3+)=c(I-),故D错;E.溶液中的
2Fe2+(aq)+I2(aq) 达到平衡,v(I-)逆=2v(I2)正,故C错;D.溶液中的各离子浓度保持不变,不是c(Fe3+)=c(I-),故D错;E.溶液中的![]() =QC,表示浓度商,如果QC=K说明达到平衡,而
=QC,表示浓度商,如果QC=K说明达到平衡,而![]() 不变说明达到平衡了;故E正确。
不变说明达到平衡了;故E正确。
(5)已知 2CuBr2(s)![]() 2CuBr(s)+Br2(g) 反应达到平衡时c(Br2)=10mol/L,将容器体积用缩至原来的一半,则c(Br2)=20mol/L,即增大压强,平衡左移,c(Br2)减小,如果温度保持不变,则反应的平衡长数不变,所以再次达到平衡时c(Br2)的浓度(mol/L)可能为1.0mol/L。答案:b。
2CuBr(s)+Br2(g) 反应达到平衡时c(Br2)=10mol/L,将容器体积用缩至原来的一半,则c(Br2)=20mol/L,即增大压强,平衡左移,c(Br2)减小,如果温度保持不变,则反应的平衡长数不变,所以再次达到平衡时c(Br2)的浓度(mol/L)可能为1.0mol/L。答案:b。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应A2 (g)+B2 (g)![]() 2C (g)达到了化学平衡状态,经测得平衡时c (A2)=0.5 mol·L-1,c (B2)=0.1 mol·L-1,c (C)=1.6 mol·L-1,若A2、B2、C的起始浓度分别以a mol·L-1,b mol·L-1,c mol·L-1表示,请填写下列空白。
2C (g)达到了化学平衡状态,经测得平衡时c (A2)=0.5 mol·L-1,c (B2)=0.1 mol·L-1,c (C)=1.6 mol·L-1,若A2、B2、C的起始浓度分别以a mol·L-1,b mol·L-1,c mol·L-1表示,请填写下列空白。
(1)a、b应满足的关系是_____________________。
(2)a的取值范围是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程中化学键被破坏的是
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HCl气体溶于水⑤MgCl2溶解于水 ⑥NaCl熔化
A. 全部 B. ②③④⑤⑥ C. ④⑤⑥ D. ⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外兴趣小组为探究铜与浓硫酸的反应情况,用如图所示的装置进行有关实验。
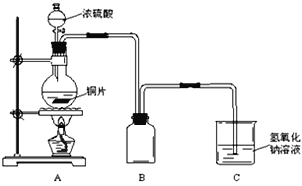
(1)装置B是用来收集实验中产生的气体的装置, 但未将导管画全,请在图中把导管补充完整__________
(2)实验中取6.4g铜片和12mL 18mol·L-1的浓硫酸分别放在圆底烧瓶和分液漏斗中,加热,直到反应结束,发现烧瓶中还有铜片剩余。该小组学生根据所学的化学知识认为还有一定量的H2SO4剩余。
①请写出铜与浓硫酸反应的化学方程式:__________
②你认为在有剩余的情况下铜片未能完全溶解的原因是__________
③下列药品能够用来证明反应结束后的烧瓶中存在余酸的是__________(填序号)。
A.铁粉 B. BaCl2溶液 C.银粉D.Na2CO3溶液
(3)为定量测定余酸的物质的量浓度,某位同学进行了如下实验:先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度(忽略反应前后溶液体积的变化)。他认为测定SO2的量的方法有多种,下列实验方案中可行的是__________(填序号,下同),最终计算得出的余酸的物质的量浓度比实际偏高的是__________
A.将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,反应结束后再次称量干燥管
B.用排水法测定装置A产生气体的体积
C.将装置A产生的气体缓缓通入足量稀硝酸酸化的硝酸钡溶液中,反应完全后,过滤、洗涤、干燥、称量沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究碳、硅元素的非金属性的相对强弱,根据要求完成下列各小题
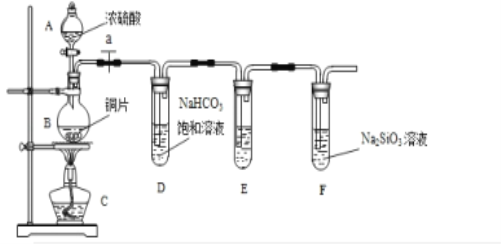
(1)实验装置: 填写所示仪器名称A__________ B___________.
(2)实验步骤:连接仪器、____________、加药品后,打开a、然后滴入浓硫酸,加热.
(3)问题探究:(已知酸性强弱:亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是___________________.装置E中足量酸性KMnO4溶液的作用是_______________;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是___________ ;
③试管D中发生反应的离子方程式是_____________________________________.
④若将铜片改为木炭,其它药品不变,也可以对该实验目的进行探究,请写出在该实验中木炭与浓硫酸反应的化学方程式_________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有NO、CO2、N2O4三种气体,它们分别都含有0.5mol氧原子,则三种气体的物质的量之比为( )
A.1∶1∶2B.1∶1∶1C.4∶2∶1D.1∶2∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
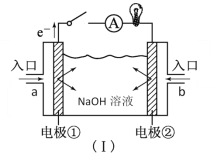
【题目】(1)如图装置(Ⅰ)为以NaOH溶液为电解质溶液的氢氧燃料电池。装置(Ⅰ)中a和b为气体进口,其中a口进入的是(填名称)____,写出电极②发生反应的电极反应式______。
(2)将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图的装置:(以下均假设反应过程中溶液体积不变)。
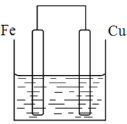
①铁片上的电极反应式为_____。
②溶液中的铜离子移向____(填铁电极或铜电极)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g) ![]() 2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如下表:下列说法不正确的是
2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如下表:下列说法不正确的是
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 反应前2min的平均速率v(Z)=2.0×10-3 mol·L-1·min-1
B. 其他条件不变,降低温度,反应达到新平衡前:v(逆)<v(正)
C. 该温度下此反应的平衡常数:K=1.44
D. 保持其他条件不变,起始时向容器充入0.32 mol气体X和0.32 mol气体Y,到达平衡时,c(Z)=0.024 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com