
 硅(Si)、镓(Ga)和硒(Se)的化合物是制造太阳能电池的重要材料.
硅(Si)、镓(Ga)和硒(Se)的化合物是制造太阳能电池的重要材料.| SiF4 | SiCl4 | SiBr4 | SiI4 | |
| 沸点(K) | 177.4 | 330.1 | 408 | 460.6 |
| Si-X键键长(pm) | 154 | 201 | 215 | 234 |
分析 (1)Ga在周期表中的位置是第四周期第IIIA族,Si在周期表中的位置是第三周期,IVA族,Si原子的核外电子排布式为1s22s22p63s23p2,一共有14个核外电子,每个电子的运动状态都不一样,据此作答;
(2)H2SeO4的酸性接近硫酸,表明Se的电负性应接近S,则在Si、Ga和Se三种元素中,电负性最大的是Se,根据VSEPR理论和杂化轨道理论判断H2SeO4中心原子的杂化方式和SeO3的空间构型;
(3)SiX4的沸点跟分子间力有关,跟键长变化无关;
(4)根据磷化镓具有金刚石晶体的晶胞,结合晶胞结构图解答.
解答 解:(1)Ga在周期表中的位置是第四周期第IIIA族,则其价电子排布式为4s24p1;Si在周期表中的位置是第三周期,IVA族,其核外电子排布式为1s22s22p63s23p2,核外电子占有的原子轨道有1s,2s,2p,3s,3p,一共有14个核外电子,每个电子为一个运动状态,因此共有14种运动状态.故答案为:4s24p1,14.
(2)H2SeO4的酸性接近于硫酸,且Se和S均为氧族元素,具有相同数目的价电子,所以Se的电负性应接近S,则在Si、Ga和Se三种元素中,电负性最大的是Se,对于H2SeO4中心原子Se,由于H2SO4中S的杂化方式为sp3,因此H2SeO4中Se的杂化方式也应为sp3,根据VSEPR理论;对于SeO3,其成键原子数BP=3,孤电子对数为$LP=\frac{6-2×3}{2}=0$,则其价电子对数为VP=BP+LP=3+0=3,根据杂化轨道理论,为sp2杂化,分子空间构型为平面三角形.故答案为:硒,sp3,平面三角形.
(3)对于SiX4,沸腾时,破坏的是分子间力,并不破坏共价键,而键长决定共价键强度,并不决定分子间力,所以键长对于沸点的参考并不具有意义,该观点是不合理的.故答案为:不合理,SiX4沸腾时破坏分子间作用力,不破坏共价键,所以共价键的键长对SiX4沸点无明显影响;
(4)磷化镓具有金刚石晶体的晶胞,根据晶胞图,磷化镓的化学式应为GaP;其熔点约1645℃,金刚石为原子晶体,GaP的晶胞与金刚石晶胞相同,结构决定性质,且其熔点也很高,所以GaP也应为原子晶体;
根据晶胞图,P原子构成的形状为正四面体;已知GaP晶体中Ga-P键键长为apm,金刚石晶胞中,C原子为sp3杂化与其余C原子成键,根据杂化轨道理论键角公式,键角应为$cosθ=\frac{-\frac{1}{4}}{1-\frac{1}{4}}=-\frac{1}{3}$,设Ga原子间距离为x,由余弦定理:$cosθ=\frac{{a}^{2}+{a}^{2}-{x}^{2}}{2•a•a}=-\frac{1}{3}$,解得$x=\frac{2\sqrt{6}}{3}a$.
故答案为:GaP;原子晶体;正四面体;$\frac{2\sqrt{6}}{3}a$.
点评 本题考查物质结构知识,基态原子核外电子排布式,价电子排布式,电负性,价层电子对互斥理论,杂化轨道理论,判断晶体类型,以及晶胞的计算.最后一空难度较大,需结合大学化学的杂化轨道键角公式和余弦定理计算.题目整体难度中等,考查知识点较综合,是中档题.


科目:高中化学 来源: 题型:选择题
| A. | 皂化反应就是乙酸乙酯等酯类物质在碱性条件下的水解 | |
| B. | 纤维素可以在人体内水解为葡萄糖,而作人类的营养物质 | |
| C. | 豆浆煮沸后蛋白质变成氨基酸 | |
| D. | 食用油反复加热会产生稠环芳烃等有害物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
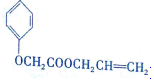 )的生产路线(反应条件略去)如图:
)的生产路线(反应条件略去)如图: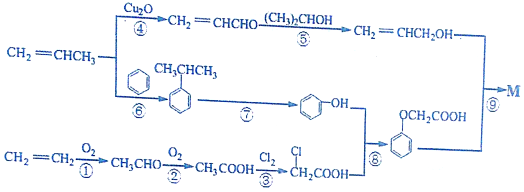
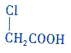 中的官能团名称是氯原子、羧基.
中的官能团名称是氯原子、羧基.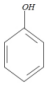 +
+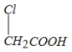 →
→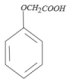 +HCl.
+HCl.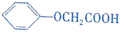 有多种同分异构体,其中既属于酚类、又属于酯类且苯环上有两个取代基的同分异构体有9种.
有多种同分异构体,其中既属于酚类、又属于酯类且苯环上有两个取代基的同分异构体有9种.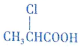 ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂).
,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂).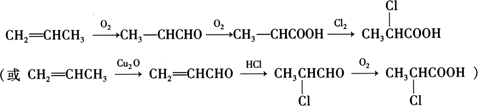 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CO32-) | B. | c(Ca2+) | C. | c(H+) | D. | Ksp(CaCO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 破坏臭氧层--氮氧化物 | |
| B. | 酸雨--二氧化碳 | |
| C. | 水体富营养化--含N,P 元素多的废水 | |
| D. | 光化学烟雾--二氧化氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用加热蒸干AlCl3溶液的方法不能制得无水AlCl3 | |
| B. | 钢铁在潮湿的空气中比在干燥空气中更容易生锈 | |
| C. | 蒸馏水和0.1mol/L NaOH溶液中的c(H+),前者大于后者 | |
| D. | 向含有少量Fe3+的MgCl2酸性溶液中加入MgCO3,可将Fe3+转化成Fe(OH)3除去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com