
在0.1mol/L的Na2CO3的溶液中,下列关系式正确的是
A.c(Na+)>c(CO32-)> c(OH-)> c(H+)
B.c(OH-)= c(HCO3-)+ c(H2CO3)
C.2c(Na+)=c(CO32-)+ c(HCO3-)> c(H2CO3)
D.c(Na+)+ c(H+)= c(OH-) + c(HCO3-) +2c(CO32-)
科目:高中化学 来源:2013-2014学年江苏省高三年级模拟考试化学试卷(解析版) 题型:填空题
中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
⑴ 将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据计算PM2.5待测试样的pH = 。
⑵ NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:

① N2(g)+O2(g) 2NO(g) △H= 。
2NO(g) △H= 。
② 当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式 。
③ 汽车汽油不完全燃烧时还产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g),已知该反应的△H>0,该设想能否实现? 。
⑶ 碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:

① 用离子方程式表示反应器中发生的反应 。
② 用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是 。
③ 用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池。电池充放电时的总反应为:Ni(OH)2+M NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为 。
NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省韶关市高三4月高考二模理综化学试卷(解析版) 题型:填空题
实验室用铜制备CuSO4溶液有多种方案,某实验小组给出了以下三种方案:

请回答有关问题:
(1)甲方案:
①写出该反应的离子方程式 ;
②为了节约原料,硫酸和硝酸的物质的量之比最佳为,n(H2SO4):n(HNO3)= 。
(2)乙方案:将6.4g铜丝放到90mL 1.5mol·L-1的稀硫酸中,控温在50℃。加入40mL 10%的H2O2,反应0.5小时,升温到60℃,持续反应1小时后,经一系列操作,得CuSO4·5H2O 20.0g【已知有关摩尔质 量:M(Cu)=64g/mol, M(CuSO4·5H2O) =250g/mol】。
①反应时温度控制在50℃~60℃,不宜过高的原因是 ;
②本实验CuSO4·5H2O的产率为 。
(3)丙方案:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质A调节pH至4 ,然后过滤、浓缩、结晶。
①物质A可选用以下的 (填序号);
A.CaO B.NaOH C.CuCO3 D.Cu2(OH)2CO3 E.Fe2(SO4)3
②反应中加入少量FeSO4可加速铜的氧化,FeSO4的作用是 ;
(4)对比甲、乙、丙三种实验方案,丙方案的优点有(写两条):
、 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省茂名市高三第二次高考模拟理综化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z关系如图,X原子的电子层数为n,最外层电子数为2n。W原子最内层电子数是最外层电子数的2倍。下列说法错误的是
X |
|
|
|
|
| Y | Z |
A.X 和Y都是非金属元素,其中X最高化合价为+5价
B.X、W的最高价氧化物在一定条件下能反应
C.元素X、W和氧元素可形成化学式为W2XO3共价化合物
D.Y、Z的氢化物的稳定性:Y<Z
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省肇庆市高三级第一次模拟考试理综化学试卷(解析版) 题型:实验题
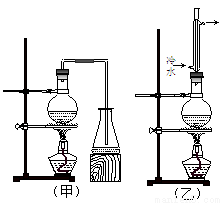
实验室制取乙酸丁酯的实验装置有如下图所示两种装置供选用。其有关物质的物理性质如下表:
| 乙酸 | 1-丁醇 | 乙酸丁酯 |
熔点(℃) | 16.6 | -89.5 | -73.5 |
沸点(℃) | 117.9 | 117 | 126.3 |
密度(g/cm3) | 1.05 | 0.81 | 0.88 |
水溶性 | 互溶 | 可溶(9g/100g水) | 微溶 |
(1)制取乙酸丁酯的装置应选用 (填“甲”或“乙”)。不选另一种装置的理由是 。
(2)该实验生成物中除了主产物乙酸丁酯外,还可能生成的有机副产物有(写出结构简式): 、 。
(3)酯化反应是一个可逆反应,为提高1-丁醇的利用率,可采取的措施是 。
(4)从制备乙酸丁酯所得的混合物中分离、提纯乙酸丁酯时,需要经过多步操作,下列图示的操作中,肯定需要的化学操作是 (选填答案编号)。
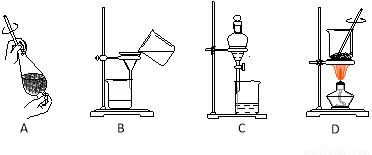
(5)有机物的分离操作中,经常需要使用分液漏斗等仪器。使用分液漏斗前必须 ;某同学在进行分液操作时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还可能 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省肇庆市高三级第一次模拟考试理综化学试卷(解析版) 题型:选择题
在溶液中加入足量Na2O2后仍能大量共存的离子组是
A.K+、AlO2-、Cl-、SO42– B.NH4+、Ba2+、Cl-、NO3-
C.Ca2+、Fe2+、NO3-、HCO3- D.Na+、Cl-、CO32-、SO32–
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省潮州市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
下图是元素周期表的一部分,下列说法正确的是( )

A.可在灰色区域“甲”中寻找催化剂
B.离子半径:W-﹥Y3-﹥X+
C.气态氢化物的稳定性:Z﹥W
D.工业上电解X和W化合物的水溶液制备X
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省清远市高三4月模拟理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列叙述正确的是(相对原子量:H—1 C—12)
A.1 mol/L氯化铜溶液中的Cu2+数小于NA
B.标准状况下,22.4 L Cl2参加任何化学反应转移的电子数都是2NA
C.28 g聚乙烯含有的碳原子数为2NA
D.1 mol CH5+所含电子数为8NA
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省广州市毕业班综合测试(二)理综化学试卷(解析版) 题型:选择题
已知反应①:

化合物Ⅱ可由化合物Ⅲ合成:

(1)化合物Ⅰ的分子式为 。反应①的反应类型为 。
(2)过量的化合物Ⅰ与HOOCCH2CH2COOH发生酯化反应,反应的化学方程式为 (注明条件)。
(3)化合物Ⅲ的结构简式为 。化合物Ⅲ可与NaOH乙醇溶液共热,反应的化学方程式 。
(4)化合物Ⅰ在一定条件下氧化生成化合物Ⅳ(分子式为C9H10O),化合物Ⅳ的一种同分异构体Ⅴ能发生银镜反应,Ⅴ的核磁共振氢谱除苯环峰外还有三组峰,峰面积之比为为2:2:1,Ⅴ的结构简式为 。
(5)一定条件下,1分子 与1分子
与1分子 也可以发生类似反应①的反应,有机化合物结构简式为
也可以发生类似反应①的反应,有机化合物结构简式为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com