
【题目】实验室制备三氯乙醛(CCl3CHO)的反应原理为:C2H5OH+4Cl2→CCl3CHO+ 5HCl,可能发生的副反应是C2H5OH+HCl→C2H5Cl+H2O。 某探究小组模拟制备三氯乙醛的实验装置如图所示(夹持、加热装置均略去)。回答下列问题:
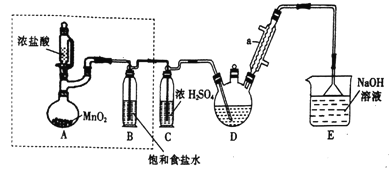
(1)仪器a的名称是______________。
(2)检查虚线框内装置气密性的方法是_________________。
(3)若撤去装置B,对实验的影响是_______________________。
(4)实验时发现D中导管口处气泡速率过快,合理的解决方法是_______________________。
(5)已知:CCl3CHO+OH-→CHCl3+HCOO- HCOO-+I2=H++2I-+CO2↑ I2+2S2O32-=2I-+S4O62-
称取0.40g产品,配成待测溶液,加入20.00mL0.100mol/L 碘标准溶液,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,并立即用0.020mol/L的Na2S2O3溶液滴定至终点。重复上述操作3次,平均消耗Na2SO3溶液20.00mL。滴定时所用指示剂是______,达到滴定终点的现象是_________,测得产品的纯度为________________。
【答案】 (球形)冷凝管 在B中加入一定量水至浸没导管,对A加热。若B中导管口有气泡产生,且停止加热,B中导管内有稳定水柱形成,则装置气密性良好 会有氯化氢杂质与乙醇反应,生成氯乙烷,导致三氯乙醛的纯度降低 停止对A加热或控制滴加盐酸量 淀粉溶液 蓝色变为无色,且半分钟内不变色 66.4%(或66.375%)
【解析】A装置利用二氧化锰与浓盐酸制备氯气,B装置用饱和食盐水除去HCl,C装置盛放浓硫酸干燥氯气,D中反应制备CCl3CHO,E装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl防止污染空气。
(1)根据装置图,仪器a为冷凝管,故答案为:冷凝管;
(2)检查虚线框内装置气密性,可以在B中加入一定量水至浸没导管,对A加热。若B中导管口有气泡产生,且停止加热,B中导管内有稳定水柱形成,则装置气密性良好,故答案为:在B中加入一定量水至浸没导管,对A加热。若B中导管口有气泡产生,且停止加热,B中导管内有稳定水柱形成,则装置气密性良好;
(3)反应生成的氯气中含有氯化氢和水蒸气,装置B中的饱和食盐水可以除去氯化氢,若撤去装置B,会有氯化氢杂质与乙醇反应,生成氯乙烷,导致三氯乙醛的纯度降低,故答案为:会有氯化氢杂质与乙醇反应,生成氯乙烷,导致三氯乙醛的纯度降低;
(4)实验时发现D中导管口处气泡速率过快,说明生成氯气的速率过快,合理的解决方法有停止对A加热或控制滴加盐酸量,故答案为:停止对A加热或控制滴加盐酸量;
(5)碘遇淀粉显蓝色,滴定时可以选用淀粉作指示剂,达到滴定终点时,蓝色变为无色,且半分钟内不变色;根据消耗的Na2S2O3计算剩余I2的物质的量0.02000molL-1×0.02L×![]() =2×10-4mol,与HCOO-反应的I2的物质的量为0.1000molL-1×0.02L-2×10-4mol=1.8×10-3mol,由CCl3CHO~HCOO-~I2可知,CCl3CHO的物质的量为1.8×10-3mol,则产品的纯度为
=2×10-4mol,与HCOO-反应的I2的物质的量为0.1000molL-1×0.02L-2×10-4mol=1.8×10-3mol,由CCl3CHO~HCOO-~I2可知,CCl3CHO的物质的量为1.8×10-3mol,则产品的纯度为![]() ×100%=66.4%,故答案为:淀粉溶液;蓝色变为无色,且半分钟内不变色;66.4%。
×100%=66.4%,故答案为:淀粉溶液;蓝色变为无色,且半分钟内不变色;66.4%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】工业上用电解法处理含镍酸性废水并得到单质镍的原理如图所示。下列说法错误的是
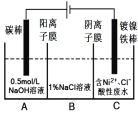
已知:①Ni2+在弱酸性溶液中发生水解;
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A. 碳棒上发生的电极反应:4OH4e= O2↑+2H2O
B. 为了提高镍的产率,电解过程中需要控制废水的pH
C. 电解过程中,B中NaCl溶液的物质的量浓度将不断减少
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有Ba2+ Mg2+ Ag+三种阳离子,现用适量的NaOH溶液、稀盐酸和Na2SO4溶液将这三种离子逐一沉淀分离,其流程如图所示:
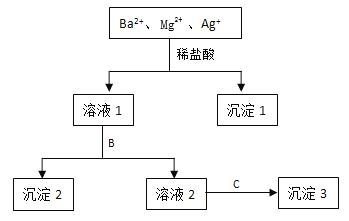
(1)沉淀1的化学式为 ,生成该沉淀的离子方程式为 。
(2)若试剂B为Na2SO4溶液,则沉淀2化学式为 。
(3)若试剂B为NaOH溶液,则生成沉淀2的离子方程式为 。
(4)如果原溶液中Ba2+ Mg2+ Ag+的浓度均为0.1 mol·L-1,且溶液中含有的阴离子只有NO3-,则溶液中NO3- 浓度为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,已知: CH3COOH的电离平衡常数Ka=1.8×10-5;H2SO3的电离平衡常数Kal=1.0×10-2、Ka2=1.0×10-7,回答下列问题:
(1)室温时,0.5 mol·L-1的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的________倍。
(2)室温时,NaHSO3的水解平衡常数Kh=________,NaHSO3溶液中的各离子浓度由大到小的顺序为________________。若向NaHSO3溶液中加入少量I2,则溶液中c(H2SO3)/c(HSO3-)将________(填“增大”、“减小”或“不变”)
(3)室温时,0.1 mol/L Na2SO3溶液的pH=________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.摩尔既是物质的数量单位又是物质的质量单位
B.物质的量是国际单位制中七个基本单位之一
C.阿伏加德罗常数是0.012kg 12C中含有的碳原子数目
D.标准状况下,1molH2O所占的体积为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度、压强下,1体积X2(气)和3体积Y2(气)化合成2体积的气体化合物,则该气体化合物的化合式为( )
A.XY3
B.XY
C.X3Y
D.X2Y3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大,其原子的最外层电子数之和为14,X与Z同主族,Y与W同主族,且X的原子半径小于Y。下列叙述正确的是
A. 简单离子半径:Y<Z
B. W元素的氧化物对应的水化物可能是弱电解质
C. X2Y2加入酸性高锰酸钾溶液中,还原产物为X2Y
D. X、Z都能分别与Y形成含非极性键的分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.78gNa2O2与足量的H2O反应,转移的电子数为2NA
B.通常条件下,28gCO和N2的混合气体中所含分子数为NA
C.标准状况下,22.4LH2O中含有的原子数为3NA
D.2mol/LCaCl2溶液中,含有Cl-个数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡.根据要求回答问题
I、铝盐的水解原理在生活中应用广泛,如明矾常作净水剂,其净水的原理是_________(用离子方程式表示);如硫酸铝常作泡沫灭火器原料之一,其原理是________________(用离子方程式表示)。
II、5℃时,将0.01mol CH3COONa和0.002mol HCl溶于水,形成1L混合溶液:
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
①____________________________;②____________________________;③____________________________。
(2)溶液中共有__________种不同的粒子(指分子和离子)。
(3)在这些粒子中,浓度为0.01mol·L-1的是__________,浓度为0.002mol·L-1的是____________。
(4)__________和__________两种粒子物质的量之和等于0.01mol。
(5)在0.5mol·L-1的NaHSO3溶液中滴入石蕊,溶液变红。试回答有关问题:
①该溶液中HSO![]() 的电离程度_________(填“大于”、“小于”或“等于”)HSO
的电离程度_________(填“大于”、“小于”或“等于”)HSO![]() 的水解程度。
的水解程度。
②溶液中Na+、HSO3-、SO32-、H+、OH-、H2SO3、H2O等粒子的浓度由大到小的顺序为__________。
III、含Cr2O72﹣的废水毒性较大,某工厂废水中含5.0×10-3mol·L﹣1的Cr2O72﹣.为了使废水的排放达标,进行如下处理:
![]()
(1)绿矾为FeSO4·7H2O,反应(I)中FeSO4与Cr2O72﹣ 的物质的量之比为_________.
(2)常温下若处理后的废水中c(Cr3+)=6.0×10﹣7mol·L﹣1,则处理后的废水的pH=______.(Ksp[Cr(OH)3]=6.0×10﹣31)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com