


科目:高中化学 来源:不详 题型:单选题
| A.在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 |
| B.过渡元素中可寻找制备催化剂及耐高温、耐腐蚀的元素 |
| C.在非金属元素区域可以寻找制备新型农药材料的元素 |
| D.周期表中第Ⅷ族元素种类最多 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电子层数少的元素原子半径一定小于电子层数多的元素的原子半径 |
| B.核外电子层结构相同的单核微粒半径相同 |
| C.质子数相同的不同单核微粒,电子数越多,半径越大 |
| D.原子序数越大,原子半径越大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子的价电子排布式是7s27p5 | B.最高化合价是+7价 |
| C.其单质是双原子分子,常温常压下呈气态 | D.阴离子具有很强的还原性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na、Mg、Al的第一电离能依次减弱 |
| B.H2S、H2O、HF的稳定性依次增强 |
| C.NaOH、Mg(OH)2、Al(OH)3的碱性依次减弱 |
| D.H4SiO4、H2CO3、H2SO4酸性依次增强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径: A>B>D>C | B.原子序数: d>c>b>a |
| C.离子半径: C>D>B>A | D.单质的还原性: A>B>D>C |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.YZ3—中的电子数为41 | B.化合物XYZ的溶液具有漂白性 |
| C.X、Y、Z均属于短周期元素 | D.Y属于第ⅤA族元素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
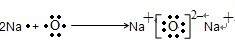
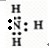
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com