
一定条件下,可逆反应N2 +3H2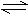 2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是( )
2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是( )
A、加催化剂,V正、V逆 都发生变化,且变化的倍数相等
B、加压,V正、V逆 都增大,且V正 增大的倍数大于V逆 增大的倍数
C、降温,V正、V逆 都减小,且V正 减小的倍数大于V逆 减小的倍数
D、增大氮气的浓度,V正、V逆 都增大,且V正 增大倍数大于V逆 增大倍数;N2 转化率减小,H2转化率增大
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
(1)肼(N2H4)是火箭发动机的燃料,它与N2O4反应时,N2O4为氧化剂,生成氮气和水蒸气。 已知:N2(g)+2O2(g)===N2O4(g) ΔH=+8.7 kJ/mol,
N2H4(g)+O2(g)===N2(g)+2H2O(g)ΔH=-534.0 kJ/mol,
则表示肼跟N2O4反应的热化学方程式
(2)用CO2和氢气合成CH3OCH3(甲醚)是解决能源危机的研究方向之一。
已知:CO(g)+2H2(g)  CH3OH(g) ΔH=-90.7 kJ·mol-1
CH3OH(g) ΔH=-90.7 kJ·mol-1
2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
则CO2和氢气合成CH3OCH3(g)的热化学方程式为
______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实能用电化学原理解释的是
A.银质物品久置表面变暗 B.远洋海轮的尾部装上一定数量的锌板
C.常温条件下,在空气中铝不易被腐蚀 D.用锌与硫酸制氢气时,往硫酸中滴少量硫酸铜
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极。

接通电源,经过一端时间后,测得乙中c电极质量增加了27克。常温下各烧杯中溶液的pH与电解时间t的关系图如上。据此回答下列问题:
(1)M为电源的 极(填写“正”或“负”),甲、乙电解质分别为 、 (填写化学式)。
(2)要使电解后丙中溶液恢复到原来的状态,应加入 物质。(填写化学式)
(3) 若电解后甲溶液的体积为25L,且产生的气体全部逸出。该溶液常温时的pH为 。
(4)写出乙烧杯中发生反应的离子方程式
(5)写出甲烧杯中发生反应的离子方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
热化学方程式C(s)+H2O(g)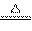 CO(g)+H2(g);△H =+131.3kJ/mol表示( )
CO(g)+H2(g);△H =+131.3kJ/mol表示( )
A.碳和水反应吸收131.3kJ能量
B.1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量
C.1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ
D.1个固态碳原子和1分子水蒸气反应吸热131.1kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应a A(s)+b B(g)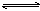 c C(g)+d D(g),反应过程中,当其它条件不变时,C的百分
c C(g)+d D(g),反应过程中,当其它条件不变时,C的百分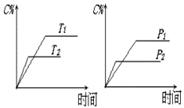 含量(C%)与温度(T)和压强(P)的关系如下图下列叙述正确的是
含量(C%)与温度(T)和压强(P)的关系如下图下列叙述正确的是
A、达平衡后,加入催化剂则C%增大
B、达平衡后,若升温,平衡左移
C、化学方程式中b >c +d
D、达平衡后,增加A的量有利于平衡向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_ 。
(2)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为 。
(3)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ/mol
C3H8(g)+5O2(g)=4H2O(l)+3CO2(g) H=-2220.0kJ/mol
实验测得甲烷与丙烷的混合气体1mol完全燃烧生成液态水和二氧化碳气体时,放热1776.7kJ,则混合气体中甲烷与丙烷的体积比为 。
(4)反应2A  B+C,在某一温度时,达到平衡。若温度升高,化学平衡正向移动,则正反应是 热反应;若B是固体,降低压强时,平衡逆向移动,则A是 态;若A是气态,加压时,平衡不移动,则B为 态,C为 态。
B+C,在某一温度时,达到平衡。若温度升高,化学平衡正向移动,则正反应是 热反应;若B是固体,降低压强时,平衡逆向移动,则A是 态;若A是气态,加压时,平衡不移动,则B为 态,C为 态。
查看答案和解析>>
科目:高中化学 来源: 题型:
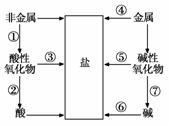
单质、氧化物、酸、碱和盐的相互关系,可以用图简单表示,限选择铁、碳、氧气、盐酸、氧化钙、二氧化碳、水、氢氧化钙8种物质作为反应物,将图中指定序号的转变用化学方程式表示(所写化学方程式不得重复)。
①C+O2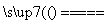 CO2
CO2
②________________________________________________________________________
③________________________________________________________________________
④________________________________________________________________________
⑤________________________________________________________________________
⑥________________________________________________________________________
⑦________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
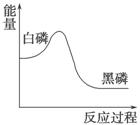
白磷在高压下隔绝空气加热后急速冷却,可得钢灰色固体黑磷,其转化过程中能量变化如图所示。下列叙述中正确的是
A.黑磷比白磷稳定 B.黑磷与白磷互为同分异构体
C.白磷转化为黑磷是氧化还原反应
D.白磷转化为黑磷是吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com