
盛有O2和NO2的混合气体的量筒倒立在盛有水的水槽中,过一段时间后,量筒内的气体体积减小为原来的一半。则原混合气体中O2和NO2的体积比是( )
A.2∶1 B.1∶2 C. 3∶2 D.3∶1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年吉林省高二上期末考试化学试卷(解析版) 题型:选择题
烷烃 是由含有一个三键的炔烃催化加氢后的产物,此炔烃可能的结构式有
是由含有一个三键的炔烃催化加氢后的产物,此炔烃可能的结构式有
A.1种 B.2种 C.3种 D.4种
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三上期末化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.H2SO4、CH3CH2OH、CH3COONa和CaO分别属于酸、碱、盐和氧化物
B.蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
C.Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到
D.日常生活中无水乙醇常用于杀菌消毒
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高一上期末考试化学试卷(解析版) 题型:选择题
由MgO、Al2O3、SiO2、Fe2O3组成的混合粉末,现取一份该混合粉末试样进行实验,首先将其溶于过量的盐酸,过滤后,得到沉淀X和滤液Y。下列叙述正确的是( )
A.该混合粉末从组成看,其成分皆是碱性氧化物
B.溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+
C.沉淀X的成分是SiO2
D.在溶液Y中加入过量的氨水,过滤得到的沉淀的成分是Fe(OH)3和Mg(OH)2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二上期末化学试卷(解析版) 题型:选择题
在下列给定条件的溶液中,一定能大量共存的离子是
A.滴加甲基橙试剂显红色的溶液中:Na +、Fe 2+、Cl-、NO3-
B.由水电离的c(H+)=1.0×10-13 mol·L﹣1的溶液中:K +、Na +、AlO2-、CO3 2-
C.常温下,pH=7 溶液中:NH4+、Al3+、NO3-、CO32-
D.KW/c(H+)=0.1 mol·L-1的溶液:Na+、K+、SiO32-、NO3-
查看答案和解析>>
科目:高中化学 来源:2015-2016年陕西西藏民族学院附属中学高一上期末化学卷(解析版) 题型:填空题
如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号.请回答下列问题:

(1)请将分类依据代号填入相应的括号内:
( )两种物质都不是电解质
( )两种物质都是钠的化合物
( )两种物质都是氧化物
( )两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入上图中某种物质M的饱和溶液,继续煮沸至溶液呈红褐色。
①物质M的化学式为______________。
②证明有红褐色胶体生成的实验操作是___________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二上期末化学试卷(解析版) 题型:填空题
在一体积为1L的密闭容器中,通入一定量的CO和H2O,在T1℃时发生如下反应:CO (g)+H2O(g)  CO2(g)+H2(g) △H<0,CO和H2O浓度变化如图,则
CO2(g)+H2(g) △H<0,CO和H2O浓度变化如图,则
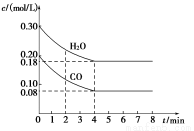
(1) 0~4 min CO的平均反应速率v(CO)=___________mol/(L.min)。
(2)达平衡时CO的转化率为____________,T1℃时该反应的平衡常数K=_______________。
(3)T2℃(高于T1℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表:
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | C1 | C2 | C3 | C3 |
4 | C1 | C2 | C3 | C3 |
5 | 0.116 | 0.216 | 0.084 | C4 |
①表中3~4 min时,反应v正__________v逆(填“>”、“<”或“=”); C1___________0.08mol/L(填“>”、“<”或“=”)。
②4~5 min时,平衡向逆反应方向移动,可能的原因是__________(填字母)。
a.增加水蒸气 b.降低温度 c.增大了CO2浓度 d.增加了氢气浓度
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上第四次摸底考试化学试卷(解析版) 题型:填空题
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了高热值的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。生产煤炭气的反应之一是:C (s)+H2O (g)  CO(g)+H2(g) ΔH = +131.4 kJ/mol
CO(g)+H2(g) ΔH = +131.4 kJ/mol
(1)在容积为3 L的密闭容器中发生上述反应,5 min后容器内气体的密度增大了0.12 g/L,用H2O表示0 ~ 5 min的平均反应速率为_________________________。
(2)关于上述反应在化学平衡状态时的描述正确的是 。
A.CO的含量保持不变
B.v正(H2O)= v正(H2)
C.容器中混合气体的平均相对分子质量保持不变
(3)若上述反应在t0时刻达到平衡(如右图),在t1时刻改变某一条件,请在右图中继续画出t1时刻之后正反应速率随时间的变化:

①缩小容器体积,t2时到达平衡(用实线表示);
②t3时平衡常数K值变大,t4到达平衡(用虚线表示)。
(4)在一定条件下用CO和H2可以制得甲醇,CH3OH和CO的燃烧热为别725.8 kJ/mol ,283.0 kJ/mol,水的摩尔蒸发焓为44.0 kJ/mol,写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式: 。
(5)如下图所示,以甲醇燃料电池作为电源实现下列电解过程。乙池中发生反应的离子方程式为 。当甲池中增重16 g时,丙池中理论上产生沉淀质量的最大值为 g。
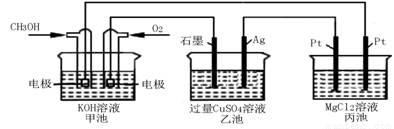
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省济宁任城区高二上学期统考化学试卷(解析版) 题型:选择题
在容积相同的甲、乙两个容器中(如图所示),分别充入2molSO2和2molO2,使它们在相同温度下发生反应2SO2(g)+O2(g) 2S03(g)并达到平衡。在反应过程中,若甲容器的容积不变,乙容器的压强不变,甲中S02的转化率为a%,乙容器中SO2的转化率为b%,则a与b的关系为
2S03(g)并达到平衡。在反应过程中,若甲容器的容积不变,乙容器的压强不变,甲中S02的转化率为a%,乙容器中SO2的转化率为b%,则a与b的关系为
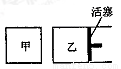
A.a﹥b B.a=b C.a﹤b D.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com