
对2SO2+O2⇌2SO3的反应.如果在密闭容器中进行,下列说法错误的是( )
|
| A. | 使用催化剂是为了加快反应速率,提高生产效率 |
|
| B. | 在上述条件下,SO2不可能100%地转化为SO3 |
|
| C. | 达到平衡时,SO2的浓度与SO3的浓度相等 |
|
| D. | 为了提高SO2的转化率,应适当提高O2的浓度 |
考点:
化学反应速率的影响因素;化学平衡的影响因素.
分析:
A、使用催化剂加快了反应速率;
B、因该反应是可逆反应,反应物不可能100%的转化;
C、达到平衡时,SO2的浓度与SO3的浓度没有必然联系;
D、达到平衡时,增大氧气浓度平衡正向移动,二氧化硫转化率增大;
解答:
解:A、使用催化剂加快了反应速率,缩短反应时间,提高反应效率,平衡不移动,故A正确;
B、因该反应是可逆反应,存在反应限度,反应物不可能100%的转化,故B正确;
C、达到平衡时,SO2的浓度与SO3的浓度可能相等,也可能不相等,要依据反应物的初始浓度及转化率,故C错误;
D、达到平衡时,增大氧气浓度平衡正向移动,二氧化硫转化率增大,故D正确;
故选C.
点评:
本题考查了影响化学平衡移动的因素,难度不大,注意影响化学反应速率和化学平衡的影响因素分析判断.


科目:高中化学 来源: 题型:
Ⅰ.如图所示的是探究金属腐蚀条件的实验装置图,请分析实验并回答下列问题:
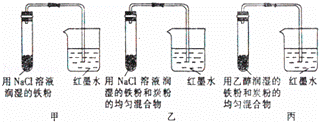
(1)若起始时甲、乙、丙3套装置的导管中液面高度相同,过一段时间后液面最高的是 .
(2)通过甲、乙装置的对比说明钢铁中碳的含量越 (填“高”或“低”)钢铁越易腐蚀.
(3)乙装置中发生电化学腐蚀时正极的电极反应式为 .
Ⅱ.利用化学反应:2FeCl3+Cu═2FeCl2+CuCl2,请你选择合适的电极材料和电解质溶液,设计一个原电池.可供选择的电极材料:铁棒、铜棒、石墨棒.可供选择的电解质溶液:CuCl2溶液、FeCl2溶液、FeCl3溶液.
请填写下列空白:
(1)选择 作正极材料, 作负极材料;选择 作电解质溶液.
(2)写出有关的电极反应式:正极: ;负极: .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质久置于空气中会发生相应的变化,其中发生了氧化还原反应的是( )
|
| A. | 浓硫酸的体积增大 | B. | 铝的表面生成致密的薄膜 |
|
| C. | 澄清的石灰水变浑浊 | D. | 氢氧化钠的表面发生潮解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质混合后,不能生成NaOH的是( )
|
| A. | Na和H2O | B. | Na2O2和H2O |
|
| C. | Ca(OH)2溶液和Na2CO3溶液 | D. | Ca(OH)2溶液和氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
“84”消毒液在日常生活中使用广泛,该消毒液无色,有漂白作用.它的有效成分是下列物质中的一种,这种物质是( )
|
| A. | NaOH | B. | NaClO | C. | KMnO4 | D. | Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列试剂的保存方式不正确的是( )
|
| A. | 金属钠保存在煤油中 |
|
| B. | HF溶液保存在棕色玻璃瓶中 |
|
| C. | 浓硫酸盛放在铝制容器中 |
|
| D. | 稀NaOH溶液保存在带橡胶塞的玻璃中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为 熔化时不需破坏化学键的是 ,熔化时只需破坏共价键的是 (填序号).
(2)在①H2、②(NH4)2SO4、③SiC、④CO2、⑤HF中,由极性键形成的非极性分子有 ,由非极性键形成的非极性分子有 ,能形成分子晶体的物质是 ,含有氢键的晶体的化学式是 ,属于离子晶体的是 ,属于原子晶体的是 .(填序号)
(3)如图表示一些晶体的结构中的某一部分.

①代表金刚石的是(填编号字母,下同) ,其中每个碳原子与 个碳原子最接近且距离相等.
②代表NaCl的是 ,每个Na+周围与它最接近且距离相等的Na+有 个.
③代表CsCl的是 ,每个Cs+与 个Cl﹣紧邻.
④代表干冰的是 ,每个CO2分子与 个CO2分子紧邻.
⑤代表石墨的是 ,它属于 晶体.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com