
【题目】证明某溶液含有Fe2+的实验方法是 ( )
A. 先滴加氯水,再滴加KSCN溶液后显红色
B. 先滴加KSCN溶液,不显红色,再滴加氯水后显红色
C. 滴加NaOH溶液,产生白色沉淀
D. 只需滴加KSCN溶液
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知:A、B、C、D四种元素,原子序数依次增大。A是短周期中原子半径最大的元素,B元素3p能级半充满;C是所在周期电负性最大的元素;D是第四周期未成对电子最多的元素。试回答下列有关的问题:
(1)写出D元素价电子的电子排布式:______________。
(2)D可形成化合物[D(H2O)6](NO3)3 。
①[D(H2O)6](NO3)3中阴离子的立体构型是_____________。NO3-中心原子的轨道杂化类型为__________。
②在[D(H2O)6] 3+中D3+与H2O之间形成的化学键称为______,1 mol [D(H2O)6] 3+ 中含有的σ键有________mol。
(3)已知B、C两种元素形成的化合物通常有两种。这两种化合物中________(填化学式)为非极性分子。另一种物质的电子式为_____________。
(4)由A、C两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如下图所示为A、C形成化合物的晶胞结构图以及晶胞的剖面图:
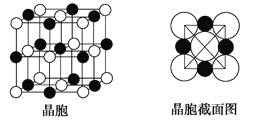
晶胞中距离一个A+最近的C-有________个,这些C-围成的图形是______________,若晶体密度为ρ g·cm-3,阿伏加德罗常数的值用NA表示,则A+的离子半径为________cm(用含NA与ρ的式子表达)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于能量转换的认识中不正确的是
A. 白炽灯工作时,电能全部转化为光能
B. 普通干电池工作时将化学能转变为电能
C. 化学反应中的能量变化,通常主要表现为热量的变化
D. 火力发电是通过化石燃料燃烧,使化学能经过一系列能量转化最终转变为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类生存与发展比不可缺的,甲醇、甲醚(CH3OCH3)均是“清洁能源”,工业上可以通过多种方法合成它们。
(1)以CO、H2为原料合成甲醚的过程中,在反应器中发生了下列反应:
a.CO(g)+2H2(g)![]() CH3OH(g) △H=- 90kJ mol-1
CH3OH(g) △H=- 90kJ mol-1
b.2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H=-23 kJ mol-1
CH3OCH3(g)+H2O(g) △H=-23 kJ mol-1
c.CO(g)+ H2O(g)![]() CO2(g)+H2(g) △H=-41 kJ mol-1
CO2(g)+H2(g) △H=-41 kJ mol-1
①选取适当的催化剂,在一定压强下,向某恒容密闭容器中通入H2和CO制备甲醚,测得的有关数据如图1所示。则制备甲醚时较适宜的生产温度范围是____________,通过理论分析得知反应c的存在能提高甲醚的产率,原因是________________________________________________。

②3CO(g)+3H2(g)![]() CH3OCH3(g)+ CO2(g) △H,则△H=____________。
CH3OCH3(g)+ CO2(g) △H,则△H=____________。
(2)用下列反应也可得到甲醚:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)。已知TK时,该反应的化学平衡常数K=1。则在相同温度下,当一恒容密闭容器中c(CO2)=2.0×10-2mol·L-1、c(H2)=1.0×10-2mol·L-1、c(CH3OCH3)=1.0×10-4mol·L-1、c(H2O)=2.0×10-4mol·L-1时,v正____________ v逆(填“>”、“ <”或“=”)。
CH3OCH3(g)+3H2O(g)。已知TK时,该反应的化学平衡常数K=1。则在相同温度下,当一恒容密闭容器中c(CO2)=2.0×10-2mol·L-1、c(H2)=1.0×10-2mol·L-1、c(CH3OCH3)=1.0×10-4mol·L-1、c(H2O)=2.0×10-4mol·L-1时,v正____________ v逆(填“>”、“ <”或“=”)。
(3)控制适当的条件,CO2与H2也可转化为甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。将CO2、H2按物质的量比为1∶3的比例加入到恒容密闭容器中反应。测得容器中n(CH3OH)在不同温度下随着时间的变化情况如图2所示.
CH3OH(g)+H2O(g)。将CO2、H2按物质的量比为1∶3的比例加入到恒容密闭容器中反应。测得容器中n(CH3OH)在不同温度下随着时间的变化情况如图2所示.
①该反应的△H____________0(填“>”、 “=”、“ <”,下同)
②若温度T1对应的化学平衡常数K1=10,则温度T2对应的化学平衡常数K2____________10。
③下列数据能说明该反应一定处于平衡状态的是____________(填选项字母)。
A.气体密度保持不变 B.n(H2)=0.3mol
C.CO2、H2的消耗速率比为1∶3 D.气体的平均相对分子质量保持不变
(4)图3为某绿色燃料电池的工作原理示意图,写出电池工作时负极上的电极反应式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D的原子序数依次增加。X、Y、Z、W分別是由这四种元素中的两种组成的常见化合物,甲为单质,乙为红棕色气体,Y为淡黄色固体。上述物质之间的转化关系如下图所示(部分反应物或生成物省略),则下列说法中正确的是( )

A. 原子半径:D>C>B>A
B. C. D的氢化物均为共价化合物
C. 相对分子质量W>X,沸点W>X
D. B的氢化物常温下一定为气态,C的氢化物常温下为液态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种元素中,其非金属性最强的是( )
A. 原子最外层电子排布为2s22p6的元素
B. 原子最外层电子排布为3s23p5的元素
C. 原子含有未成对电子最多的第二周期元素
D. 位于周期表中第三周期ⅢA族的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求填空:
(1)写出甲基电子式:_______________
(2)![]() 则合成它的单体是___________________
则合成它的单体是___________________
(3)用系统命名法给下列有机物命名
 _________________________
_________________________
 ________________________
________________________
 __________________________
__________________________
(4)下列化合物中含有2个手性碳原子的是 __________________________
A. ![]() B.
B. ![]() C. CH3CH2COOH
C. CH3CH2COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、R为原子序数依次增大的六种元素,位于元素周期表的前四周期。B元素原子含有3个能级,且毎个能级所含的电子数相同;D的原子核外有8种运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子3d轨道上有4个未成对电子。请回答下列问题:
(1)写出C基态原子的价层电子排布____________,F基态原子的外围电子排布式_____________。
(2)下列说法正确的是____________(填序号)。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2
B.笫一电离能由小到大的顺序:B<C<D
C.N2与CO为等电子体,结构相似
D.稳定性:H2O>H2S,水分子更稳定的原因是水分子间存在氢键
(3)F元素位于周期表中_________区,其离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。向F的硫酸盐溶液中通人过量的C与A形成的气体X可生成[F(X)4]2+,该离子的结构式为__________(用元素符号表示)。
(4)某化合物与F(I)(I表示化合价为+ 1)结合形成下图所示的离子,该离子中碳原子的杂化方式为____________________。

(5)B单质的一种同素异形体的晶胞如下图所示,则一个晶胞中所含B原子的个数为____________。

(6)D与F形成离子个数比为1:1的化合物,晶胞与NaCl类似,设D离子的半径为apm, F离子的半径bpm,则该晶胞的空间利用率为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com