
| A. | 酒精 | B. | K2SO4晶体 | C. | 熔融NaCl | D. | Cu |
科目:高中化学 来源: 题型:解答题
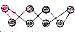 )所示,该单质与NaOH溶液反应时产物之一为Na2SO3,写出该反应的离子方程式:3S8+48OH-=16S2-+8SO32-+24H2O.
)所示,该单质与NaOH溶液反应时产物之一为Na2SO3,写出该反应的离子方程式:3S8+48OH-=16S2-+8SO32-+24H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 最外层电子数 | 次外层电子数 |
| D | x | x+4 |
| E | x+1 | x+4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水泥、玻璃、陶瓷等硅酸盐材料都不溶于水,所以所有的硅酸盐都不溶于水 | |
| B. | 水泥的主要成分有硅酸三钙(3CaO•SiO2)、硅酸二钙(2CaO•SiO2)及其他一些成分,所以硅酸盐都是氧化物 | |
| C. | 陶瓷分为土器、陶器、瓷器、炻器,与原料粘土的纯度有关 | |
| D. | 普通玻璃是透明的,所以硅酸盐也是透明的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相对分子质量之比为1:2:3 | B. | 质子数之比为2:3:6 | ||
| C. | 中子数之比为0:3:4 | D. | 体积之比为6:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com