
| A. | V(NaOH)=0时,c(H+)=1×10-2 mol/L | |
| B. | V(NaOH)=10 mL时,c(H+)=1×10-7 mol/L | |
| C. | V(NaOH)<10 mL时,可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) | |
| D. | V(NaOH)>10 mL时,2c(C2O42-)>c(Na+)>c(HC2O4-) |
分析 A.草酸是二元中强酸,V(NaOH)=0时,NaHC2O4不能完全电离出H+;
B.V(NaOH)=10 mL时,溶液中溶质为Na2C2O4;
C.V(NaOH)<10mL时,溶液中溶质为NaHC2O4、Na2C2O4;
D.V(NaOH)>10 mL时,溶液中溶质为NaOH、Na2C2O4.
解答 解:A.草酸是二元中强酸,V(NaOH)=0时,NaHC2O4不能完全电离出H+,则c(H+)<1×10-2mol•L-1,故A错误;
B.V(NaOH)=10 mL时,溶液中溶质为Na2C2O4,溶液显碱性,则c(H+)<1×10-7mol•L-1,故B错误;
C.V(NaOH)<10mL时,溶液中溶质为NaHC2O4、Na2C2O4,当电离等于水解,即c(H+)=c(OH-),存在c(Na+)=2c(C2O42-)+c(HC2O4- ),故C正确;
D.V(NaOH)>10 mL时,溶液中溶质为NaOH、Na2C2O4,C2O42-水解生成HC2O4-,则离子浓度为c(Na+)>2c(C2O42-)>c(HC2O4- ),故D错误;
故选C.
点评 本题考查溶液中离子的关系,明确溶液中的溶质是解答的关键,并注意利用溶液中水解的程度及电离的程度、电荷守恒来分析解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 摩尔是国际科学界建议采用的一种物理量 | |
| B. | 物质的摩尔质量等于该物质的相对分子质量 | |
| C. | O22-离子的摩尔质量是32 g•mol-1 | |
| D. | 1 mol H2O的质量为18 g•mol- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 成分 | 糖类 | 蛋白质 | 油脂 | 水 | 维生素 | 钙 | 铁 | 锌 |
| 质量/g | 0 | 16.6 | 5.2 | 78.2 | 0.00004 | 0.038 | 0.0008 | 0.0009 |
| A. | 六大类 | B. | 五大类 | C. | 四大娄 | D. | 三大类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
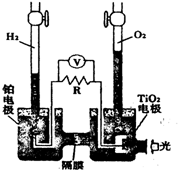 在光照射下可使水分解:2H2O $?_{光}^{TiO_{2}}$ 2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
在光照射下可使水分解:2H2O $?_{光}^{TiO_{2}}$ 2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )| A. | 该装置可以将电能转化为化学能 | |
| B. | 铂电极上发生的反应为:2H++2e-=H2↑ | |
| C. | 该装置工作时,电流由TiO2电极经R流向铂电极 | |
| D. | 该装置工作时,TiO2电极附近溶液的pH变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
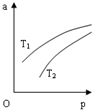 在密闭容器中发生反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ•mol-1,NH3 在 平衡混合气体中的体积分数(a)与温度(T)、压强(p)的关系如图所示.下列判 断正确的是( )
在密闭容器中发生反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ•mol-1,NH3 在 平衡混合气体中的体积分数(a)与温度(T)、压强(p)的关系如图所示.下列判 断正确的是( )| A. | T1>T2 | |
| B. | 其他条件不变,增大压强,可提高单位时间内 NH3的产量 | |
| C. | 升高温度,该反应的化学平衡常数增大 | |
| D. | 当 n(N2):n(H2):n(NH3)=1:3:2 时,反应一定达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该溶液中 c(H2CO3)>c(CO32-) | |
| B. | 常温下,该溶液的pH>7 | |
| C. | 该溶液中阳离子总数小于阴离子总数 | |
| D. | 常温下,加水稀释时$\frac{c({H}^{+})•c(C{O}_{3}^{2-})}{c({H}_{2}C{O}_{3})}$不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,22.4LH2O含有的分子数为 NA | |
| B. | 4.4g二氧化碳气体中所含的原子个数与4.2g氮气中所含的原子个数不相等 | |
| C. | 常温常压下,11.2LNH3所含的原子数目为2NA | |
| D. | 常温常压下,48gO3含有的氧原子数为3 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com