
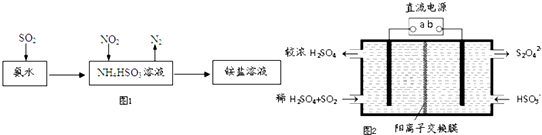
 SO2和NOx都是大气污染物.
SO2和NOx都是大气污染物.分析 (1)依据CO和NO2通过催化转化器将其转化为无污染的两种气体是氮气和二氧化碳进行解答;
(2)根据盖斯定律,一个反应无论是一步完成还是分为几步完成,其热效应是相同的,据此分析;
(3)根据氧化还原反应中氧化剂和还原剂的特点结合常见的氧化剂和还原剂来回答;
(4)根据图示可知,二氧化硫溶于氨水后得到的HSO3-与二氧化氮发生氧化还原反应,据此写出离子方程式;
(5)①b极上HSO3-得电子生成S2O42-;
②依据在碱性条件下,阴极排出的溶液为S2O42-,二氧化氮与其发生反应生成氮气.
解答 解:(1)CO和NO2通过催化转化器将其转化为无污染的两种气体是氮气和二氧化碳,反应为2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2,
故答案为:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2;
(2)根据盖斯定律,一个反应无论是一步完成还是分为几步完成,其热效应是相同的,已知:
N2(g)+O2(g)=2NO(g)△H=+180.6kJ•mol-1 ①
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1 ②
将②-①可得:C(s)+2NO(g)=CO2(g)+N2(g)△H=-393.5kJ•mol-1-180.6kJ•mol-1=-574.1KJ/mol,
故答案为:-574.1;
(3)将NO2变成无害的N2中,氮元素的化合价降低了,二氧化氮做氧化剂,需要加入还原剂,在下列四种物质:a.NH3 b.CO2 c.SO2 d.CH3CH2OH中,能被二氧化氮氧化具有还原性的物质有乙醇和NH3,
故答案为:还原剂;ad;
(4)氨水可以将SO2和NO2同时吸收处理,二氧化硫与氨水反应生成亚硫酸氢根离子,NO2被吸收的离子方程式是2NO2+4HSO3-=N2+4SO42-+4H+,
故答案为:2NO2+4HSO3-=N2+4SO42-+4H+.
(5)①依据图示可知,阴极上HSO3-得电子生成S2O42-,阴极区发生反应2HSO3-+2H++2e-=S2O42-+2H2O;
故答案为:2HSO3-+2H++2e-=S2O42-+2H2O;
②阴极排出的溶液为S2O42-,二氧化氮与其发生反应,S2O42-中硫元素由+3价,变为硫酸根中硫元素为+4价,S2O42-被氧化是还原剂;二氧化氮中的氮元素化合价为+4价变为氮气0价,二氧化氮被还原为氧化剂,依据原子守恒和得失电子守恒可得,发生的离子方程式为4S2O42-+2NO2+8OH-═8SO42-+N2+4H2O,
故答案为:4S2O42-+2NO2+8OH-═8SO42-+N2+4H2O.
点评 本题考查盖斯定律的应用、氧化还原反应反应的分析以及电解原理的分析应用等,比较综合,题目难度中等,侧重于考查学生的分析能力和对基础知识的综合应用能力.


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 15N中含有7个中子 | |
| B. | N2和N70属于同位素 | |
| C. | N5+中含有36个电子 | |
| D. | 若NH5为离子化合物,则其既含有离子键,又含有共价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.
利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.| 编号 | 温度 | 压强 | c始(CO) | c始(H2O) |
| Ⅰ | 530℃ | 3MPa | 1.0mol•L-1 | 3.0mol•L-1 |
| Ⅱ | X | Y | 1.0mol•L-1 | 3.0mol•L-1 |
| Ⅲ | 630℃ | 5MPa | 1.0mol•L-1 | 3.0mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
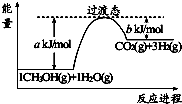
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:FeCl3(aq)+3KSCN(aq)?3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是( )
已知:FeCl3(aq)+3KSCN(aq)?3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是( )| A. | A点与B点相比,A点的血红色沉淀更多 | |
| B. | 加入KCl固体可以使溶液由D点变到C点 | |
| C. | 反应处于D点时,一定有V(正)<V(逆) | |
| D. | 若T1、T2温度下的平衡常数分别为K1、K2,K1<K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
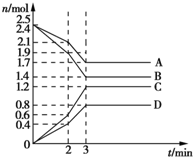 在某容积为2L的密闭容器中,A、B、C、D四种气体物质发生可逆反应,其物质的量n(mol)随时间t(min)的变化如图所示.下列说法正确的是( )
在某容积为2L的密闭容器中,A、B、C、D四种气体物质发生可逆反应,其物质的量n(mol)随时间t(min)的变化如图所示.下列说法正确的是( )| A. | 前2min内,v(A)=0.2 mol/(L•min) | |
| B. | 在2min时,图象发生改变的原因只可能是增大压强 | |
| C. | 其他条件不变,3min时体系的压强不再发生变化 | |
| D. | 增加气体D的浓度,A的反应速率随之减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2NH3(g)△H=-92kJ•mol-1.
2NH3(g)△H=-92kJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灼烧某白色粉末,火焰呈黄色,证明原粉末中含有Na+,无K+ | |
| B. | 实验中要配制500mL0.2mol•L-1KCl溶液,需用托盘天平称量7.45gKCl固体 | |
| C. | 加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结,证明NH4Cl固体易升华 | |
| D. | 做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸.如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加沸石 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com