
| A. | 简单离子的半径:r(A)<r(C)<r(D)<r(E) | |
| B. | 元素B的最简单气态氧化物的稳定性比C的强 | |
| C. | D2C2与A2C2的漂白原理相同 | |
| D. | 元素E的氧化物能溶于B或D的最高价氧化物对应的水化物中 |
分析 短周期元素A、B、C、D的原子序数逐渐增大,C的一种单质具有杀菌的作用,少量能使人精神振奋,且为短周期元素,为O元素;
E的合金是目前使用比较广泛的合金,则E是Fe元素;
A、B元素原子序数都小于O元素,A、B的最高正价与最低负价之和都为0,A原子序数小于B,则A是H元素、B是C元素;
D与A同主族,且原子序数大于O元素,则D是Na元素,
A.电子层数越多,其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小;
B.元素的非金属性越强,其氢化物的稳定性越强;
C.Na2O2与H2O2都具有强氧化性,能漂白某些物质;
D.元素Fe的氧化物能溶于强酸.
解答 解:短周期元素A、B、C、D的原子序数逐渐增大,C的一种单质具有杀菌的作用,少量能使人精神振奋,且为短周期元素,为O元素;
E的合金是目前使用比较广泛的合金,则E是Fe元素;
A、B元素原子序数都小于O元素,A、B的最高正价与最低负价之和都为0,A原子序数小于B,则A是H元素、B是C元素;
D与A同主族,且原子序数大于O元素,则D是Na元素,
A.电子层数越多,其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,所以离子半径r(A)<r(D)<r(C)<r(E),故A错误;
B.元素的非金属性越强,其氢化物的稳定性越强,非金属性C>B,所以元素B的最简单气态氧化物的稳定性比C的弱,故B错误;
C.Na2O2与H2O2都具有强氧化性,能漂白某些物质,其原理都是利用物质的强氧化性,原理相同,故C正确;
D.元素Fe的氧化物能溶于强酸,B的最高价氧化物的水化物是弱酸、D的最高价氧化物的水化物是强碱,Fe的氧化物不能溶于碳酸、氢氧化钠溶液,故D错误;
故选C.
点评 本题考查原子结构和元素周期律,为高考高频点,明确元素周期表结构、物质结构、物质性质是解本题关键,熟练掌握元素周期律,题目难度中等.


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案科目:高中化学 来源: 题型:解答题
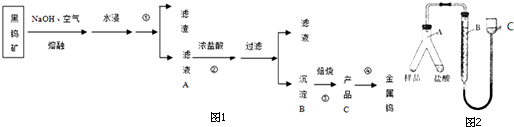
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 研发易降解的生物农药符合十八大报告中提到的生态文明建设 | |
| B. | 熟吃西红柿要比生吃维生素C的损失小 | |
| C. | 教育部发出禁令是因为吸烟也会产生多种有害有毒物质 | |
| D. | 大量焚烧田间秸秆会产生雾霾而影响空气质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 周期表中有A、B、C三种原子序数依次增大的元素,A是地壳中含量最多的金属元素,B的价层电子排布为nsn-1npn+1,C是生活中的一种常用金属且其原子的外围电子排布为3d104s1.
周期表中有A、B、C三种原子序数依次增大的元素,A是地壳中含量最多的金属元素,B的价层电子排布为nsn-1npn+1,C是生活中的一种常用金属且其原子的外围电子排布为3d104s1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 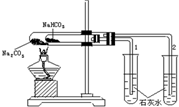 用如图装置比较Na2CO3与NaHCO3的稳定性 | |
| B. |  用如图装置吸收NH3,并防止倒吸 | |
| C. | 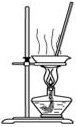 用如图装置蒸干AlCl3饱和溶液制备AlCl3晶体 | |
| D. | 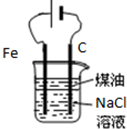 用如图装置制取Fe(OH)2沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 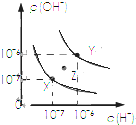 表示不同条件下水的电离平衡曲线,图中各点温度:X>Z>Y | |
| B. | 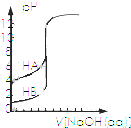 表示浓度相同的两种一元酸分别用0.1 mol/L NaOH溶液滴定曲线,酸性:HA>HB | |
| C. | 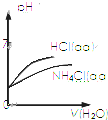 表示pH相同的NH4Cl溶液和HCl溶液分别加同体积水稀释二者pH的变化曲线 | |
| D. | 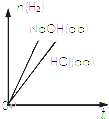 表示向等体积、等物质的量浓度的盐酸和NaOH溶液中分别加入足量铝粉,产生H2的物质的量随时间的变化曲线 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com