

| A. | X可能是金属铜 | B. | Y不可能是氢气 | C. | Z可能是氯化钠 | D. | Z可能是三氧化硫 |
分析 A.X+Y→Z,Z电解生成X、Y,说明电解电解质本身,所以X可能是金属铜,Y可能为氯气,根据铜、氯及其化合物的性质分析解答;
B.X+Y→Z,Z电解生成X、Y,说明电解电解质本身,所以X可能是氯气,Y可能为氢气,符合条件;
C.Z可能是氯化钠,X、Y只能为氢气、氯气中的一种,电解氯化钠溶液生成氢氧化钠、氢气、氯气,电解水和电解质,不符合Z电解生成X、Y条件;
D.Z可能是三氧化硫,X、Y只能为二氧化硫、氧气中的一种,三氧化硫和水反应生成硫酸,电解硫酸本质为电解水,不符合Z电解生成X、Y条件.
解答 解:A.X+Y→Z,Z电解生成X、Y,说明电解电解质本身,所以X可能是金属铜,Y可能为氯气,反应为:X+Y→Z,Cu+Cl2$\frac{\underline{\;点燃\;}}{\;}$CuCl2,Z为CuCl2,电解CuCl2溶液:CuCl2$\frac{\underline{\;电解\;}}{\;}$Cu+Cl2↑,故A正确;
B.X+Y→Z,Z电解生成X、Y,说明电解电解质本身,所以X可能是氯气,Y可能为氢气,反应为:X+Y→Z,H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,Z为HCl,电解HCl溶液:2HCl$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑,故B错误;
C.Z可能是氯化钠,X、Y只能为氢气、氯气中的一种,X+Y→Z,2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$2NaCl,Z电解:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,不符合Z电解生成X、Y条件,故C错误;
D.Z可能是三氧化硫,X、Y只能为二氧化硫、氧气中的一种,X+Y→Z,2SO2+O2$?_{△}^{催化剂}$2SO3,三氧化硫和水反应SO3+H2O=H2SO4生成硫酸,电解硫酸本质为电解水,电解水生成氢气和氧气,不符合Z电解生成X、Y条件,故D错误;
故选A.
点评 本题考查无机物的推断,题目难度不大,注意把握推断的突破口,通常从物质的颜色,性质和反应现象为突破口进行推断,本题可结合选项提供的物质以及反应的条件进行分析,注意X+Y→Z,Z电解生成X、Y,说明电解电解质本身为解答该题的关键,学习中注意相关基础知识的积累.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:H2SO4>H3PO4 | B. | 非金属性:Cl>Br | ||
| C. | 碱性:NaOH>Mg(OH)2 | D. | 热稳定性:Na2CO3>NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
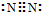 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液晶态介于晶体状态和液态之间,液晶具有一定程度的晶体的有序性和液体的流动性 | |
| B. | 常压下,0℃时冰的密度比水的密度小,水在4℃时密度最大,这些都与分子间的氢键有关 | |
| C. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 | |
| D. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. B.
B.
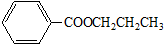
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.| 电负性 | 熔沸点 | 稳定性 | 酸性 |
| O>N | NH3>PH3 | Fe2+< Fe3+ | H3PO4<HNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com