
 .
.分析 某烃的相对分子质量为56,用商余法$\frac{56}{14}$=4,正好除尽,所以该烃为烯烃或环烷烃,分子式为C4H8,如可使酸性高锰酸钾褪色,则为烯烃,可为CH2=CH-CH2-CH3、CH3-CH=CH-CH3、 等,以此解答该题.
等,以此解答该题.
解答 解:(1)$\frac{56}{14}$=4,正好除尽,所以该烃为烯烃或环烷烃,分子式为:C4H8,故答案为:C4H8;
(2)能使酸性高锰酸钾褪色,应为烯烃,可能结构为:CH2=CH-CH2-CH3、CH3-CH=CH-CH3、 ,
,
故答案为:CH2=CH-CH2-CH3、CH3-CH=CH-CH3、 ;
;
(3)加成反应特点为双键中一个键断开,其他原子或原子团加在不饱和碳上,原来的碳架不变,故1-丁烯和2-丁烯加氢后都得到正丁烷,2-甲基-1-丙烯加氢后得到异丁烷,
故答案为:2;
(4)1-丁烯和溴化氢加成可得到1-氯丁烷和2-氯丁烷,2-丁烯和溴化氢加成得到2-氯丁烷,2-甲基-1-丙烯和溴化氢加成得到2-甲基-1-氯丙烷和2-甲基-2-氯丙烷,共4种,
故答案为:4.
点评 本题考查了分子式的确定,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握烯烃的性质及同分异构体书写.掌握加成反应的特点是解题的关键,难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
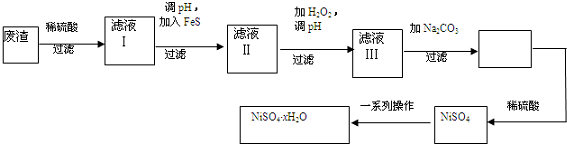
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| … | E | A | B | ||
| C | … | D |
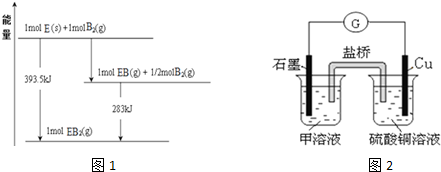
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的CaCl2和CaO2含有的离子数 | |
| B. | 等温等压下,质子数相等的CO、N2、C2H2三种气体含有的原子数 | |
| C. | 同温、同压、同体积的CO和NO含有的质子数 | |
| D. | 物质的量相同的铁和铝分别与足量氯气完全反应时转移的电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热的反应一定是吸热反应 | |
| B. | 放热反应在常温下一定很容易发生 | |
| C. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| D. | 伴随能量变化的物质变化都是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属原子失去电子越多,还原性越强 | |
| B. | 盐酸酸化的高锰酸钾溶液氧化性更强 | |
| C. | 工业上镁铝单质都是电解对应熔融的氯化物得到的 | |
| D. | 强氧化剂与强还原剂不一定能发生氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com