
对于电解质的导电能力,下列说法正确的是 ( )
A.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
B.导电能力强的溶液一定是浓溶液
C.相同温度下,导电能力强的溶液中离子个数一定多
D.相同的温度下,单位体积中的离子个数越多,阴离子或阳离子所带电荷的绝对值越大,溶液的导电能力越强
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
某研究小组同学为探究Fe3+能否氧化SO2,设计了如下的实验装置(假设实验中所用装置的气密性良好)。
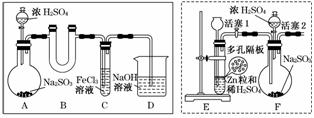
(1)甲同学利用实线框内的装置制取SO2,并进行探究实验。
①装置A中发生反应的化学方程式为_________________________________________。
②装置B的作用是________________________________________________________。
③反应一段时间后,甲同学取出装置C中的少量溶液,向其中加入盐酸酸化的BaCl2溶液,观察到有白色沉淀生成。由此得出结论:Fe3+可以氧化SO2。
(2)乙同学认为甲同学的实验不严谨,用虚线框内的装置代替装置A,先让装置E内的试剂反应一段时间后,关闭活塞1,打开活塞2,又反应片刻后,取装置C中的少量溶液,向其中加入酸性KMnO4溶液,观察到KMnO4溶液紫红色褪去。由此得出结论:Fe3+可氧化SO2,且可被SO2还原成Fe2+。
①该实验制取H2时需用浓硫酸配制450 mL 3 mol·L-1的稀硫酸,所需的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管外,还需用到______________________________________。
配制过程中若其他操作无误,但没有洗涤烧杯与玻璃棒,则所配制溶液的浓度会___ _____(填“偏高”、“偏低”或“无影响”)。
②在该实验过程中,H2所起的作用是________________________________________。
(3)丙同学认为甲、乙两位同学的实验均不严谨,为此利用乙同学的实验装置及操作重新进行实验。待装置F内的试剂反应一段时间后,取装置C中的少量溶液,向其中加入盐酸酸化的BaCl2溶液,得出与甲同学相同的结论。
①甲同学实验不严谨的原因是________(填序号)。
A.SO2的溶解度太小
B.SO2与Fe3+不发生反应
C.H2SO3与BaCl2溶液不反应
D.装置中的空气与SO2进入水中可生成H2SO4
②乙同学的实验结论不严谨的原因是___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
超氧化钾和二氧化碳反应生成氧气(4KO2+2CO2===2K2CO3+3O2),在医院、矿井、潜水、高空飞行中用作供氧剂。13.2 L(标准状况)CO2和KO2反应后,气体体积变为18.8 L(标准状况),计算反应消耗的KO2的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:
0.2 mol纯钠在只含氧气和氯气的密闭容器中燃烧,反应后冷却至常温,容器内固体 的质量不可能为 (
的质量不可能为 (  )。
)。
A.4.8 g B.6.2 g
C.7.8 g  D.11.7 g
D.11.7 g
查看答案和解析>>
科目:高中化学 来源: 题型:
取3.5 g某二价金属的单质投入50 g溶质质量分数为18.25%的稀盐酸中,反应结束后,金属仍有剩余;若取2.5 g该金属投入相同质量、相同质量分数的稀盐酸中,等反应结束后,加入该金属还可以反应。该金属的相对原子质量为 ( )
A.24 B.40 C.56 D.65
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A.常温常压下,48gO3含有的氧原子数为3NA
B.1.8g的NH4+离子中含有的电子数为1.1NA
C.常温常压下,11.2L氧气所含的原子数为NA
D.2.4g金属镁变为镁离子时失去的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中的离子,能在溶液中大量共存的是 ( )
A.Mg2+、H+、C1-、OH- B.Na+、Ba2+、CO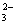 、NO
、NO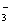
C.Na+、H+、Cl-、CO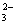 D.K+、Cu2+、NO
D.K+、Cu2+、NO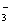 、SO
、SO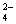 、
、
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,将PCl3(g)和Cl2(g)充入体积不变的的2L密闭容器中发生下述反应:PCl3(g)+Cl2(g)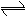
 PCl5(g);5min末达到平衡,有关数据如下表。
PCl5(g);5min末达到平衡,有关数据如下表。
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度(mol/L) | 2.0 | 1.0 | 0 |
| 平衡浓度(mol/L) | C1 | C2 | 0.4 |
下列判断不正确的是
当反应达到平衡状态,容器中Cl2为1.2mol
反应5min内,V(PCl3)=0.08mol/(L·min)
达到平衡后再向容器中充入少量PCl5(g),混合气体的平均摩尔质量将变小。
平衡后移走2.0molPCl3和1.0molCl2,在相同条件下再达到平衡时,C(PCl5)<0.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下发生反应:2A(g)+2B(g)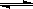 xC(g)+2D(g),在2L密闭容器中,把4molA和
xC(g)+2D(g),在2L密闭容器中,把4molA和
2molB混合,2min后达到平衡时生成1.6molC,又测得反应速率V(D)=0.2mol·L-1·min-1,
下列说法正确的是
A.A和B的转化率均是20% B.x = 4
C.平衡时A的物质的量为2.8mol D.平衡时气体压强比原减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com