
|
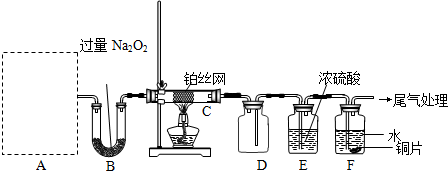
无色的混合气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100 mL甲气体经过下图所示实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为
| |
| [ ] | |
A. |
NH3、NO2、O2 |
B. |
NH3、NO、CO2 |
C. |
NH3、NO2、CO2 |
D. |
NO、CO2、N2 |
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:阅读理解
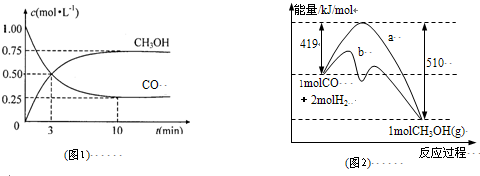
| c(CH3OH) |
| c(CO)×c2(H2) |
| c(CH3OH) |
| c(CO)×c2(H2) |
| n(CH3OH) |
| n(CO) |
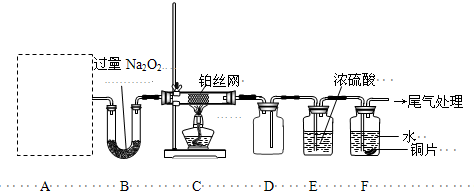
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
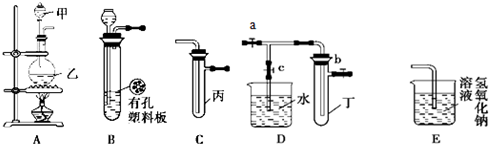
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入 NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(A)如下图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。
![]()
实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒的现象 |
1 | 10 mL FeSO4溶液 | 10 mL NH3 | 生成白色沉淀,后变色 |
2 | 20 mL H2S | 10 mL SO2 |
|
3 | 30 mL NO2(主要) | 10 mL H2O(l) | 剩有无色气体,活塞自动向内压缩 |
4 | 15 mL Cl2 | 40 mL NH3 |
|
试回答下列问题:
(1)实验1中,沉淀最终变为___________色,写出沉淀变色的化学方程式_______________。
(2)实验2甲针筒内的现象是:有________生成,活塞___________移动(填“向外”“向内”或“不”)。反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入__________溶液中。
(3)实验3中,甲中的30 mL气体是NO2和N2O4的混合气体,那么甲中最后剩余的无色气体是__________,写出NO2与H2O反应的化学方程式_______________________________。
(4)实验4中,已知:3Cl2+2NH3![]() N2+6HCl。甲针筒除活塞有移动、针筒内有白烟产生外,气体的颜色变化为___________,最后针筒内剩余气体的体积约为______________mL。
N2+6HCl。甲针筒除活塞有移动、针筒内有白烟产生外,气体的颜色变化为___________,最后针筒内剩余气体的体积约为______________mL。
(B)某实验小组用下列装置进行乙醇催化氧化的实验。

(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式
_____________________________________________________________________
_____________________________________________________________________。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇氧化反应是________反应。
(2)甲和乙两个水浴作用不相同。
甲的作用是____________________;乙的作用是_____________________。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是____________________________。集气瓶中收集到的气体的主要成分是______________。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有__________。要除去该物质,可先在混合液中加入______________(填写字母)。
a.氯化钠溶液 b.苯
c.碳酸氢钠溶液 d.四氯化碳
然后,再通过_____________(填实验操作名称)即可除去。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com