
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
分析 ①元素的非金属性越强,对应的氢化物越稳定;
②根据H2O、CH3COOH、HCl的电离程度越大,其离子结合质子能力越弱来分析;
③元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
④根据同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大判断.
解答 解:①非金属性F>O>S,元素的非金属性越强,对应的氢化物越稳定,所以稳定性:HF>H2O>H2S,故①错误;
②因H2O、CH3COOH、HCl的电离程度:HCl>CH3COOH>H2O,所以结合质子能力OH->CH3COO->Cl-,故②正确;
③非金属性Cl>S>P,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,所以酸性:H3PO4<H2SO4<HClO4 故C错误;
④同周期元素从左到右原子半径逐渐减小,则原子半径Na>Mg,一般来说,原子核外电子层数越多,原子半径越大,则Na>Mg>O,故④正确;
故选B.
点评 本题考查元素周期律知识,侧重于学生的分析能力和基本概念的理解和运用的考查,注意元素的性质与对应单质、化合物的关系,把握元素周期律的递变规律是解答该类题目的关键,难度不大.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题
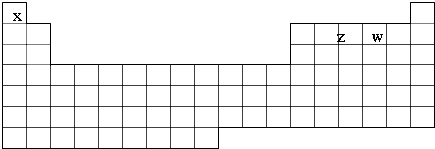
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体的本质特征是胶粒直径在1nm~100nm | |
| B. | 煮沸饱和FeCl3溶液可以制得Fe(OH)3胶体 | |
| C. | 丁达尔现象可以用来区别胶体和溶液 | |
| D. | 溶液和胶体的分散质都能通过滤纸孔隙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
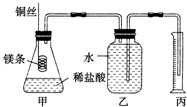 某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答下列问题.该小组设计的简单实验装置如图所示:
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答下列问题.该小组设计的简单实验装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向右移动 | B. | A的体积分数比原平衡时小 | ||
| C. | A的转化率增大 | D. | 正反应速率增大,逆反应速率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
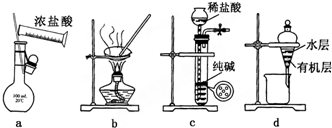
| A. | 用图a所示装置配制100mL0.100mol•L-1稀盐酸 | |
| B. | 用图b所示装置蒸干FeCl3饱和溶液制备FeCl3固体 | |
| C. | 用图c所示装置制取少量纯净的CO2气体 | |
| D. | 用图d所示装置分离CCl4萃取碘水后已分层的有机层和水层 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
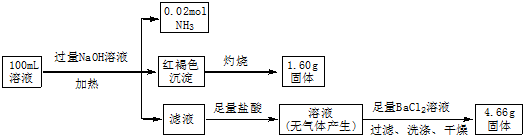
| A. | SO42-、NH4+和Na+ 一定存在,CO32-一定不存在 | |
| B. | SO42-、NH4+一定存在,Na+ 和CO32-一定不存在 | |
| C. | c(Fe3+)=0.1 mol•L-1 | |
| D. | c(Cl-)≥0.4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚丙烯的链节是-CH2-CH2-CH2- | |
| B. | 向苯酚溶液中滴加Na2CO3溶液:2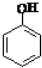 +CO${\;}_{3}^{2-}$→ +CO${\;}_{3}^{2-}$→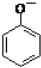 +CO2↑+H2O +CO2↑+H2O | |
| C. | 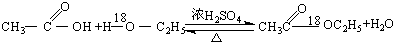 | |
| D. | 苯的同系物能使酸性高锰酸钾溶液褪色,说明烃基对苯环的性质产生了较大的影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com