
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol•L-1 | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol•L-1 | 0.010 | 0.010 | 0.020 |
| A. | 平衡时,乙中CO2的转化率大于60% | |
| B. | 平衡时,甲中和丙中H2的转化率均是60% | |
| C. | 平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol•L-1 | |
| D. | 反应开始时,丙中的反应速率最快,甲中的反应速率最慢 |
分析 A.根据平衡常数计算平衡时二氧化碳的转化率,根据增加一种反应物浓度要吧提高另一种反应的转化率判断;
B.该反应是气体体积前后不变的反应,所以甲和丙为等效平衡,据此判断;
C.根据平衡常数计算平衡时二氧化碳的浓度;
D.根据影响化学反应速率的因素判断.
解答 解:A.设甲容器中平衡时反应掉的二氧化碳的浓度为xmol/L,根据K=$\frac{{x}^{2}}{(0.01-x)^{2}}$=2.25,得x=0.006,所以CO2的转化率为60%,H2的转化率也是60%,在乙容器中相当于是甲容器中增加了H2,CO2的转化率增大,故A正确;
B.设甲容器中平衡时反应掉的氢气的浓度为xmol/L,根据K=$\frac{{x}^{2}}{(0.01-x)^{2}}$=2.25,得x=0.006,所以H2的转化率是60%,又甲和丙为等效平衡,所以甲中和丙中H2的转化率均是60%,故B正确;
C.由A的分析可知,平衡时甲容器中c(CO2)是0.004mol/L,而甲和丙为等效平衡,但丙的起始浓度为甲的两倍,所以平衡时,丙中c(CO2)是0.008mol/L,故C错误;
D.根据浓度越大反应速率越快可知,反应开始时,丙中的反应物浓度最大,所以反应速率最快,甲中的反应物浓度最小,所以反应速率最慢,故D正确;
故选C.
点评 本题主要考查了化学平衡的相关计算、影响化学反应速率的因素、等效平衡的思想等知识点,侧重考查学生的分析能力和计算能力,中等难度,解题时要注意比较反应前后气体体积的变化特征.


科目:高中化学 来源: 题型:多选题
| A. | 工业上用生石灰做脱硫剂 | B. | 氯化铁腐蚀铜刻制印刷电路板 | ||
| C. | 明矾可用做净水剂 | D. | 氢氟酸可用玻璃器皿存放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在无色溶液中:Na+、Fe3+、NO3-、Cl- | |
| B. | pH=11的透明溶液中:Na+、K+、MnO4-、CO32- | |
| C. | 在含有HCO3-的溶液中:H+、K+、SO42-、Cl- | |
| D. | 含有大量Fe2+的溶液中:H+、K+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
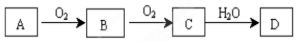
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Cl2与足量的NaOH溶液反应,转移的电子数为1NA | |
| B. | 标况下,11.2L SO3所含的分子数目为0.5 NA | |
| C. | 1molNa2O2溶于水转移的电子数为2NA | |
| D. | 含4 mol HCl的浓盐酸与足量的二氧化锰反应,生成Cl2分子的数目为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com