
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2LH2中含有的氢原子一定为1mol | |
| B. | 16gCH4在标准状况下的体积约为22.4L | |
| C. | 71gCl2中含有的氯原子数约为6.02×1023 | |
| D. | 1L 0.5 mol/LBaCl2溶液中Cl-的物质的量浓度为0.5 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .化合物
.化合物 是合成药物的中间体,请写出以有机物A和
是合成药物的中间体,请写出以有机物A和 为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸和NaOH溶液反应 | B. | 氯化氢溶于水 | ||
| C. | 稀硫酸与BaCl2溶液反应 | D. | 氯化氢与氨气反应生成NH4Cl固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
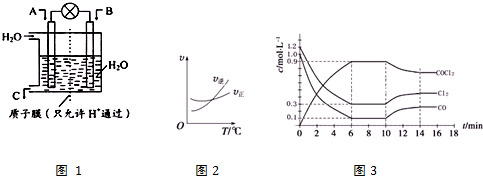
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
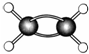 科学家致力于二氧化碳的“组合转化”技术的研究,把过多二氧化碳转化为有益于人类的物质.
科学家致力于二氧化碳的“组合转化”技术的研究,把过多二氧化碳转化为有益于人类的物质. 代表氢原子,
代表氢原子, 代表碳原子)和水,该有机物的结构简式为CH2=CH2.
代表碳原子)和水,该有机物的结构简式为CH2=CH2.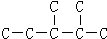 ,该烷烃的名称为2,3-二甲基戊烷;其一溴代物有6种.
,该烷烃的名称为2,3-二甲基戊烷;其一溴代物有6种.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com