
| A. | 天然气 | B. | 油田气 | C. | 水煤气 | D. | 沼气 |
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2═Ba2++2OH- | B. | NaHSO4═H++Na++SO42- | ||
| C. | MgCl2═Mg2++2Cl- | D. | NaHCO3═H++Na++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 0min | 5min | 10min | |
| CO | 0.01 | 0.0056 | |
| H2O | 0.01 | 0.0156 | |
| CO2 | 0 | 0.0044 | |
| H2 | 0 | 0.0044 |
| A. | 0~5min 时用H2O(g)表示的平均反应速率为1.2×10-3 mol/( L.min) | |
| B. | 5min~10min 改变的条件是再加入了0.1mol H2O(g) | |
| C. | 200℃时,若向容器中充入0.01mol CO(g)、0.01mol H2O(g)、0.01molCO2(g)、0.01molH2(g),达平衡时,CO(g)为1.2×10-3mol/L | |
| D. | 300℃时,若向容器中充入0.01mol CO(g)、0.01mol H2O(g)、0.02molCO2(g)、0.02molH2(g),则开始反应时ν(正)<ν(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
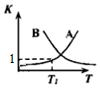
| CO体积分数% 投料比 | 温度/℃ | ||||
| 200 | T2 | T3 | T4 | ||
| $\frac{n({H}_{2}0)}{n(C0)}$ | 1 | 1.70 | 2.73 | 6.00 | 7.85 |
| 3 | 0.21 | 0.30 | 0.84 | 1.52 | |
| 5 | 0.02 | 0.06 | 0.43 | 0.80 | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
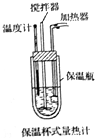 化学反应过程中总是伴随着能量的变化,能量间可以相互转化.
化学反应过程中总是伴随着能量的变化,能量间可以相互转化.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液:Al3+、Na+、Cl-、HCO3- | |
| B. | 能使pH试纸呈红色的溶液:Na+、NH4+、Fe3+、NO3- | |
| C. | FeCl3溶液:K+、Na+、NO3-、SCN- | |
| D. | 由水电离出的C(H+)=10-13mol/L的溶液:Na+、K+、SiO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com