
【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义。
I.己知某些化学键的键能数据如下:
化学键 | C=O | C-O | C-H | H-H | O-H |
键能/kJ·mol-1 | a | b | c | d | e |
(1)CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=____kJ/mol(用字母表示)。
CH3OH(g)+H2O(g) △H=____kJ/mol(用字母表示)。
II.将燃煤废气中的CO 转化为二甲醚的反应原理为:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
(2)已知在某压强下,该反应在不同温度、不同投料比时,达平衡时CO2的转化率如下图所示:

①该反应的△H_____0(填“>”或“<”)。
②700K,将4molH2和2molCO2投入2L恒容密闭容器中,反应经3min达到平衡,则CH3OCH3(g)在0~3min内的生成速率为_________。
(3)某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,下列物理量不再发生变化时,能说明反应达到平衡状态的是_______。
A.二氧化碳的浓度 B.容器中的压强
C.气体的密度 D.CH3OCH3与H2O的物质的量之比
(4)某温度下,在体积可变的密闭容器中,改变起始时加入各物质的量,在不同的压强下,平衡时CH3OCH3(g)的物质的量如下表所示:
P1 | P2 | P3 | |
I.2.0molCO26.0molH2 | 0.10mol | 0.04mol | 0.02mol |
II.1.0molCH3OCH33.0molH2O | X1 | Y1 | Z1 |
①P3______P2(填“>”、“<”或“”);
②P2下,I中CH3OCH3的平衡转化率为_______。
III.在一定条件下,CO2(g)+H2(g)![]() CO(g)+H2O(g)。
CO(g)+H2O(g)。
(5)在1L密闭容器中若CO2(g)、H2(g)初始投料均为1mol,反应达平衡时CO在平衡混合气中的体积分数为25%,则该温度下该反应的平衡常数K=____。向此容器中再充入CO2(g)、H2(g)各0.5mol,则平衡_______(填“正向移动”、“逆向移动”或“不移动”)。
【答案】 2a+3d-b-3c-3e < 0.05mol·L-1·min-1 ABC < 96% 1 正向移动
【解析】I. 焓变=反应物的键能—生成物的总键能,CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=(2a+3d-b-3c-3e) kJ·mol-1;(2)①投料比相同时,升高温度CO2的转化率减小,该反应的ΔH <0;③700K,将4molH2和2molCO2投入2L恒容密闭容器中,投料比[n(H2)/n(CO2)] = 2,反应经3min达到平衡,由图可知CO2转化率为30%,则
CH3OH(g)+H2O(g) ΔH=(2a+3d-b-3c-3e) kJ·mol-1;(2)①投料比相同时,升高温度CO2的转化率减小,该反应的ΔH <0;③700K,将4molH2和2molCO2投入2L恒容密闭容器中,投料比[n(H2)/n(CO2)] = 2,反应经3min达到平衡,由图可知CO2转化率为30%,则
2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O (g)
CH3OCH3(g)+3H2O (g)
开始时浓度(mol/L) 1 2 0 0
改变的浓度(mol/L) 0.3 0.9 0.15 0.45
平衡时浓度(mol/L) 0.7 1.1 0.15 0.45
则CH3OCH3(g)在0~3min内的生成速率为![]() mol·L-1·min-1;(3)某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,下列物理量不再发生变化时,能说明反应达到平衡状态的是根据化学平衡定义,反应物浓度不变达到平衡状态,选项A正确;该反应的气体物质的量为变量,所以在体积一定的密闭容器中,压强为变量,容器中的压强不变一定平衡,选项B正确;该反应有水生成,气体质量为变量,气体的密度为变量,密度不变一定平衡,选项C正确;CH3OCH3与H2O都是生成物,CH3OCH3与H2O的物质的量之比始终为1:3,故CH3OCH3与H2O的物质的量之比不变,不一定平衡,选项D错误。答案选ABC;(4)①2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(l),反应为气体体积减小的反应,增大压强平衡正向进行,从而导致生成物的量增大,图表中平衡时CH3OCH3(g)的物质的量可知P3<P2;②I起始量.2.0molCO2,6.0molH2 ,P2下平衡三行计算,
mol·L-1·min-1;(3)某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,下列物理量不再发生变化时,能说明反应达到平衡状态的是根据化学平衡定义,反应物浓度不变达到平衡状态,选项A正确;该反应的气体物质的量为变量,所以在体积一定的密闭容器中,压强为变量,容器中的压强不变一定平衡,选项B正确;该反应有水生成,气体质量为变量,气体的密度为变量,密度不变一定平衡,选项C正确;CH3OCH3与H2O都是生成物,CH3OCH3与H2O的物质的量之比始终为1:3,故CH3OCH3与H2O的物质的量之比不变,不一定平衡,选项D错误。答案选ABC;(4)①2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(l),反应为气体体积减小的反应,增大压强平衡正向进行,从而导致生成物的量增大,图表中平衡时CH3OCH3(g)的物质的量可知P3<P2;②I起始量.2.0molCO2,6.0molH2 ,P2下平衡三行计算,
2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(l)
起始量(mol) 2 6 0 0
变化量(mol) 0.08 0.24 0.04
平衡量(mol) 1.92 5.76 0.04
逆向进行 2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(l)
起始量(mol) 0 0 1 3
变化量(mol) 1.92 5.76 0.96
平衡量(mol) 1.92 5.76 0.04
P2下Ⅲ中CH3OCH3的平衡转化率=![]() ×100%=96%;
×100%=96%;
(5)设CO2的转化率为x, CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
起始量(mol) 1 1 0 0
变化量(mol) x x x x
平衡量(mol) 1-x 1-x x x
![]() 25%,则x=0.5mol,该温度下该反应的平衡常数K=
25%,则x=0.5mol,该温度下该反应的平衡常数K=![]() 。向此容器中再充入CO2(g)、H2(g)各0.5mol,Q=
。向此容器中再充入CO2(g)、H2(g)各0.5mol,Q=![]() ,则平衡正向移动。
,则平衡正向移动。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.用苯萃取碘水中的碘,后分液,水层从上口倒出
B.金属氧化物都是碱性氧化物
C.三氯化铁溶液滴入氢氧化钠溶液可制备氢氧化铁胶体
D.可用量筒准确量取9.5mL水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有2molSO2的恒容容器中通入过量氧气发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,下列说法中正确的是
2SO3(g) ΔH<0,下列说法中正确的是
A. 氧气过量,所以充分反应后可生成2molSO3
B. 反应达平衡的过程中,混合气体的平均相对分子质量不断减小
C. 反应达平衡后,升高温度,SO2的转化率减小
D. 反应达平衡后,增大SO2的浓度,平衡右移,故SO2的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下CH3COOH和NH3·H2O的电离常数相等,现向10mL浓度为0.01mol/L的氨水溶液中滴加相同浓度的CH3COOH溶液,在滴加过程中溶液的pH与所加醋酸的体积关系如图所示。下列说法错误的是

A. n=7
B. 水的电离程度先增大再减小
C. 常温下,0.01mol/L的氨水溶液中NH3·H2O的电离度为3.98%
D. Y点溶液中c(NH3·H2O)+(OH-)=c(CH3COO-)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态溴原子的核外电子排布式为________,其核外电子所占用的最高能级电子云形状为_________。
(2)尿素(H2NCONH2)分子中,原子杂化轨道类型有_____,σ键与π键数目之比为______。
(3)铍与铝元素性质相似。下列有关铍与铝的叙述正确的是_____ (填标号)。
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液都呈酸性
(4)NH3分子中∠HNH键角为107°,而配离子[Zn(NH3)6]2+中∠HNH的键角为109.5°。配离子[Zn(NH3)6]2+中∠HNH键角变大的原因是_______。
(5)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。
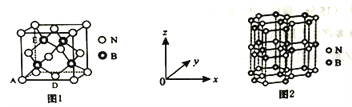
①晶胞中的原子坐标参数可表示晶胞内部各原子的相对位置。图1中原子坐标参数A为(0,0,0),D为(0.5,0.5,0),则E原子的坐标参数为________。
②已知六方氮化硼同层中B-N距离为acm,密度为dg/cm3,则层与层之间距离的表达式为___pm.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在NaCl、MgCl2、MgSO4形成的混合溶液中,c(Na+)=0.1mol/L,c(Mg2+)=0.25mol/L,c(Cl﹣)=0.2mol/L,则c(SO42﹣)为( )
A.0.15 mol/L
B.0.10 mol/L
C.0.25 mol/L
D.0.20 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是
A. 使酚酞显红色的溶液中:Na+、 Al3+、SO42-、Cl-
B. ![]() =1×1012的溶液中:NH4+、Na+、CO32-、SiO32-
=1×1012的溶液中:NH4+、Na+、CO32-、SiO32-
C. c(Fe2+)=1 mol·L-1的溶液中:Mg2+、H+、MnO4-、SO42-
D. 无色透明溶液中:K+、Ca2+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图所示装置从海水中提取CO2,有利于减少环境中温室气体的含量。下列说法正确的是

A. 通电后,a室的pH增大
B. 中间隔室发生的反应:HCO3-+H+==CO2↑+H2O,从而提取CO2
C. 阴极反应式为2H+-2e-==H2↑
D. 当电路中通过1mol电子的电量时,会有22.4LCO2气体产生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com