
| 时间/min | CO | H2O(g) | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | C1 |
| 6 | 0.096 | 0.266 | 0.104 | C2 |
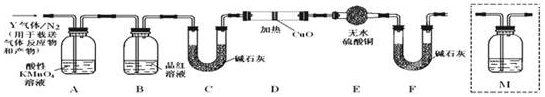
分析 (1)根据盖斯定律来计算丙烷完全燃烧的反应热,由①2C3H8(g)+7O2 (g)=6CO (g)+8H2O△H1=-2741.8kJ/mol,
②2CO (g)+O2(g)=2CO2 (g)△H2=-566kJ/mol,根据盖斯定律可知,$\frac{①+②×3}{2}$可得;
(2)①反应为气体体积不变的反应,利用平衡的特征“等”、“定”及由此衍生的一些量来分析;
②第4~5min之间,反应物的浓度增大,二氧化碳的浓度减小,平衡向正反应方向移动;第5~6min之间,生成物的浓度增大,且水的浓度增大,则改变条件是增大水的量;化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比;根据化学平衡常数计算生成物的浓度,转化率等于反应的浓度与初始浓度的比;420℃时,该化学反应的平衡常数为9,又知397℃时该反应的平衡常数为12,升高温度平衡常数减小,则平衡逆向移动,正反应为放热反应;
(3)原电池内部阴离子向由正极向负极移动;原电池负极放出氧化反应,丙烷在负极放电,与O2-结合生成二氧化碳与水;
(4)电解池阴极发生还原反应,阳离子在阴极放电,H+(实际是水)在阴极放电生成氢气,产生氢氧根离子,氢氧根离子与镁离子反应生成氢氧化镁沉淀.
解答 解:(1)由①2C3H8(g)+7O2 (g)=6CO (g)+8H2O△H1=-2741.8kJ/mol,
②2CO (g)+O2(g)=2CO2 (g)△H2=-566kJ/mol,
根据盖斯定律可知,$\frac{①+②×3}{2}$可得C3H8(g)+5O2 (g)=3CO2 (g)+4H2O,
其反应热为$\frac{(-2741.8KJ/mol)+(-566KJ/mol)×3}{2}$=-2219.9KJ/mol,
故答案为:-2219.9KJ/mol;
(2)①a.由反应可知,反应前后的压强始终不变,则体系中的压强不发生变化,不能判断平衡,故a错误;
b.v正(H2)=v逆(CO),说明一氧化碳正逆反应速率相同,说明反应达到平衡状态,故b正确;
c.,因体积不变,气体的总质量不变,气体体积不变,所以混合气体的平均摩尔质量始终不变,不发生变化,不能判断平衡,故c错误;
d.CO2的浓度不再发生变化,由平衡的特征“定”可知,则化学反应达到平衡,故d正确;
故答案为:bd;
②第4~5min之间,反应物的浓度增大,二氧化碳的浓度减小,平衡向正反应方向移动,则改变条件是增大氢气浓度,第5~6min之间,生成物的浓度增大,且水的浓度增大,则改变条件是增大水浓度,420℃时,设参加反应的CO的浓度为x,则K=$\frac{x×x}{(0.01-x)(0.01-x)}$=9,解之得x=0.0075mol/L,则在此条件下的转化率为$\frac{0.0075mol/L}{0.01mol/L}$×100%=75%,420℃时,该化学反应的平衡常数为9,又知397℃时该反应的平衡常数为12,升高温度平衡常数减小,则平衡逆向移动,正反应为放热反应,则△H<0,
故答案为:增加H2浓度;增加H2O(g)浓度;75%;<;
(3)原电池内部阴离子向由正极向负极移动,所以电池内部O2-由正极移向负极;原电池负极放出氧化反应,丙烷在负极放电,与O2-结合生成二氧化碳与水,电极反应式为C3H8+10O2--20e-=3CO2+4H2O.
故答案为:负;C3H8+10O2--20e-=3CO2+4H2O.
(4)电解池阴极发生还原反应,阳离子在阴极放电,水在阴极放电,电极反应式为2H2O-2e-=H2↑+2OH-,同时反应反应Mg2++2OH-=Mg(OH)2↓,故电解开始后阴极的现象为:有无色气体生成,有白色沉淀生成.
故答案为:有无色气体生成,有白色沉淀生成.
点评 本题考查盖斯定律、反应热的计算、化学反应速率、原电池、影响化学平衡的因素、平衡常数的有关计算,题目难度中等.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:解答题
| t/s c/(mol•L-1) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/(mol•L-1) | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2)/(mol•L-1) | 0 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2熔点高,可用作光导纤维 | |
| B. | Li还原性强且质轻,常用作负极材料 | |
| C. | Fe2(SO4)3具有氧化性,能用作净水剂 | |
| D. | SO2能杀菌,可用于漂白纸浆 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 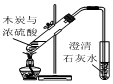 用如图所示装置验证反应产物二氧化碳 | |
| B. | 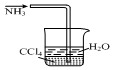 用如图装置吸收氨气并防止倒吸 | |
| C. |  如图装置配制100 mL 1 mol•L-1的硫酸 | |
| D. | 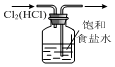 用如图装置除去氯气中的氯化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100℃时,某溶液pH=6,则该溶液一定显酸性 | |
| B. | 25℃时,0.1mol/L的NaHSO3溶液pH=4,溶液中c(SO32-)<c(H2SO3) | |
| C. | 25℃时,pH=3的硫酸溶液与pH=11的氨水等体积混合,所得溶液呈酸性 | |
| D. | 室温下,10mL0.1mol/L CH3COOH溶液与5mLO.lmol/LNaOH溶液混合,所得溶液中有:2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成1 mol NaNO3需消耗0.4 mol KMnO4 | |
| B. | 反应过程中溶液的pH减小 | |
| C. | 该反应中NO${\;}_{2}^{-}$被还原 | |
| D. | X可以是盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
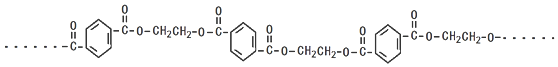
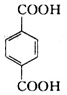 ,分子较小的单体含氧官能团名称是羟基.
,分子较小的单体含氧官能团名称是羟基.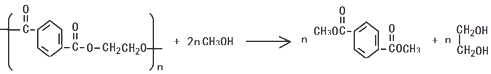 .
.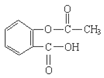 )的原料.
)的原料.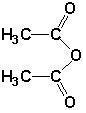 )反应生成阿司匹林的化学方程式:
)反应生成阿司匹林的化学方程式: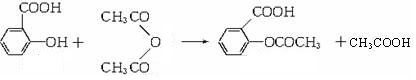 .
. ,该同分异构体符合以下条件:
,该同分异构体符合以下条件:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com