
| A、X、Y、Z的稳定性逐渐减弱 |
| B、A、B、C、D只有5种原子 |
| C、X、Y、Z三种化合物的还原性逐渐升高 |
| D、自然界中存在多种由A、B、C、D四种元素组成的化合物 |


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
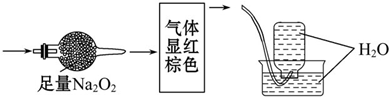
| A、NO2、N2 |
| B、NO、CO2 |
| C、NO2、CO2 |
| D、NO、CO2、N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、四种溶液的KW相同,由水电离的c(H+):①=③>②=④ |
| B、向等体积的四种溶液中分别加入100 mL水后,溶液的pH:③>④>②>① |
| C、①、②、④溶液分别与足量铝粉反应,生成H2的量:①最大 |
| D、将②、③两种溶液混合后,若pH=7,消耗溶液的体积为:③>② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子化合物中都含有离子键 |
| B、离子化合物中的阳离子只能是金属离子 |
| C、离子化合物如能溶于水,其水溶液一定可以导电 |
| D、溶于水可以导电的化合物一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com