
 氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要的地位.工业制硝酸的主要反应之一是
氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要的地位.工业制硝酸的主要反应之一是| 浓度/mol.l-1 | C(NH3) | C(O2) | C(NO) | C(H2O) |
| 时间/min | ||||
| 起始 | 4.0 | 5.5 | 0 | 0 |
| 第2min | 3.2 | 4.5 | 0.8 | 1.2 |
| 第4min | 2.0 | 3.0 | 2.0 | 3.0 |
| 第6min | 3.0 | 3.0 | 2.0 | 3.0 |
分析 (1)依据热化学方程式中物质的量和焓变计算反应的氨气物质的量,结合转化率=$\frac{消耗量}{起始量}$计算;
(2)依据反应过程中一氧化氮随反应进行浓度增大,达到平衡状态浓度不变分析;
(3)A、先分析图表,再根据外界对化学平衡的影响分析;
B、根据浓度商与化学平衡常数的相对大小判断移动方向;
(4)根据题意:①$\frac{1}{2}$CH4(g)+2NO2(g)=2NO(g)+$\frac{1}{2}$CO2(g)+H2O(g)△H=$\frac{1}{2}$×(-574kJ•mol-1)=-287kJ•mol-1;
CH4(g)+2NO(g)=N2(g)+$\frac{1}{2}$CO2(g)+H2O(g)△H=$\frac{1}{2}$×(-1160kJ•mol-1)=-580kJ•mol-1;
根据盖斯定律反应CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)可以看成是①+②,根据盖斯定律来计算反应的焓变,进而书写热化学方程式.
解答 解:(1)如果将4molNH3和5molO2放入容器中,达到平衡时放出热量0.8akJ,则
4NH3(g)+5O2(g)?4NO(g)+6H2O(g),△H=-akJ•mol-1
起始量 4mol 5mol 0 0
焓变 4mol aKJ
放热 n 0.8aKJ
n=3.2mol
氨气转化率=$\frac{3.2mol}{4mol}$×100%=80%;
故答案为:80%;
(2)容积固定的密闭容器中进行上述反应,NO的浓度与时间关系分析可知随反应进行,一氧化氮随反应进行浓度增大,达到平衡状态浓度不变,所以速率关系为:v(a正)<v(b逆)=v(c正),
故答案为:v(a正)<v(b逆)=v(c正);
(3)A、根据生成物第2min及第4min时物质的量浓度的变化量知,第2min到第4min时反应速率增大,且平衡向正反应方向移动,则第2min时改变了条件,使用催化剂反应速率增大,最后达到平衡状态,故选D;
B、第4min时,各种物质的浓度不变,说明该反应达到平衡状态,化学平衡常数K=$\frac{2.{0}^{4}×3.{0}^{6}}{2.{0}^{4}×3.{0}^{5}}$=3.0,在与第4min相同的温度下,若起始向容器中加入NH3、O2、NO和H2O(g)的浓度都为2moI/L,Q=$\frac{{2}^{4}×{2}^{6}}{{2}^{4}×{2}^{5}}$=2<3,则平衡向正反应方向移动,故答案为:正反应方向进行;
(4)根据题意:①$\frac{1}{2}$CH4(g)+2NO2(g)=2NO(g)+$\frac{1}{2}$CO2(g)+H2O(g)△H=$\frac{1}{2}$×(-574kJ•mol-1)=-287kJ•mol-1;
CH4(g)+2NO(g)=N2(g)+$\frac{1}{2}$CO2(g)+H2O(g)△H=$\frac{1}{2}$×(-1160kJ•mol-1)=-580kJ•mol-1;
根据盖斯定律反应CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)可以看成是①+②,CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1.
所以△H=-287kJ•mol-1-580kJ•mol-1=-867kJ•mol-1,
故答案为:-867kJ•mol-1.
点评 本题考查了反应热量变化的计算和盖斯定律应用,化学平衡移动原理的分析判断,平衡常数、反应速率计算,掌握基础是关键,题目难度较大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L SO3所含的分子数为0.5 NA | |
| B. | 12 g石墨和C60的混合物中质子总数一定为6NA个 | |
| C. | 在熔融状态下,l mol NaHSO4完全电离出的阳离子数目为2NA | |
| D. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下,在2L的恒容密闭容器内发生的反应中M、N的物质的量随反应时间变化的曲线如图所示.请回答下列问题:
一定温度下,在2L的恒容密闭容器内发生的反应中M、N的物质的量随反应时间变化的曲线如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 101kPa时,H2(g)+1/2O2(g)═H2O(g)△H=-248kJ•mol-1,H2的燃烧热为248kJ•mol-1 | |
| B. | 利用盖斯定律可以计算难以测量的反应热 | |
| C. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,含1 mol NaOH的氢氧化钠的溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ的热量 | |
| D. | 相同条件下,如果1 mol H原子所具有的能量为E1,1 mol H2所具有能量为E2,则2E1=E2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
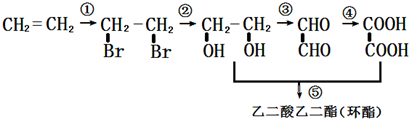
 ;
; +H2O,;
+H2O,; .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 氯水具有多种性质,根据新制氯水分别与如图五种物质发生的反应填空(氯水足量):
氯水具有多种性质,根据新制氯水分别与如图五种物质发生的反应填空(氯水足量):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com