
Ⅰ.已知A、B、C、D四种分子所含原子的数目依次为1、3、6、6,且都含有18个电子,B、C是由两种元素的原子组成,且分子中两种原子的个数比均为1 :2。D是一种有毒的有机物。
(1)组成A分子的原子的元素符号是 ;
(2)从B分子的立体结构判断,该分子属于 分子(填“极性”或“非极性”);
(3)C分子中都包含_______个σ键,_______个π键。
(4)D的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明D是何物质):
_____________________________________________________________________。
II.CO的结构可表示为C≡O,N2的结构可表示为N≡N。
(5)下表是两者的键能数据:(单位:kJ/mol)
| A-B | A=B | A≡B | |
| CO | 357.7 | 798.9 | 1071.9 |
| N2 | 154.8 | 418.4 | 941.7 |
结合数据说明CO比N2活泼的原因:__________________________________________。
Ⅲ.Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关。
(6)基态Ni原子的核外电子排布式为 __ ____ ,基态Cu原子的价电子排布式为___________________________。
(7)Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 ___________ (填晶体类型)。
科目:高中化学 来源: 题型:
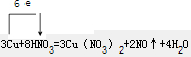

| △ |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
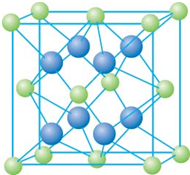 已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B形成的晶体其晶胞结构如图,图中小球代表D,大球代表B.请回答:
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B形成的晶体其晶胞结构如图,图中小球代表D,大球代表B.请回答: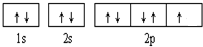



| 4×78g/mol |
| ag/cm3×6.02×1023/mol |
| 4×78g/mol |
| ag/cm3×6.02×1023/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A~I分别表示中学化学中常见的一种物质,它们之间相互转化关系如图所示(部分反应物、生成物没有列出),且已知A、B、C、D、E、F六种物质中均含同一种元素,A、I是两种常见的金属单质.H在常温下是一种常见的非金属气态单质.
A~I分别表示中学化学中常见的一种物质,它们之间相互转化关系如图所示(部分反应物、生成物没有列出),且已知A、B、C、D、E、F六种物质中均含同一种元素,A、I是两种常见的金属单质.H在常温下是一种常见的非金属气态单质.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com