
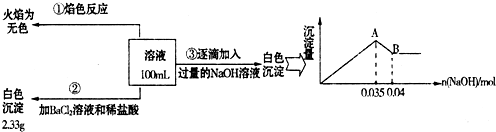
分析 无色废水确定无Fe3+,根据实验①确定无Na+,根据实验②确定有SO42-,根据实验③确定有Al3+和Mg2+,因为CO32-与Al3+不能共存,所以无CO32-;故溶液中存在的离子为:Al3+、Mg2+、SO42-,根据硫酸钡沉淀求出n(SO42-),根据图象求出n(Al3+)和n(Mg2+),再根据电荷守恒确定有没有NO3-,以此解答该题.
解答 解:无色废水确定无Fe3+,根据实验①确定无Na+,根据实验②确定有SO42-,根据实验③确定有Al3+和Mg2+,因为CO32-与Al3+不能共存,所以无CO32-;故溶液中存在的离子为:Al3+、Mg2+、SO42-,根据硫酸钡沉淀求出n(SO42-),根据图象求出n(Al3+)和n(Mg2+),再根据电荷守恒确定有没有NO3-,
(1)焰色反应的操作步骤简记为洗、烧、蘸、烧、洗,洗铂丝的试剂是盐酸,为避免黄色光的干扰,滤去黄光,在观察K+的焰色时,必须要透过蓝色钴玻璃观察,
故答案为:盐酸;蓝色钴玻璃;
(2)配制1.0mol/L的NaOH溶液100mL,根据实验步骤所需仪器:玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管、100mL容量瓶、烧杯,
故答案为:100mL容量瓶、烧杯;
(3)实验③中A→B过程是Al(OH)3与OH-发生反应,其方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)由以上分析可知溶液中存在的离子为:Al3+、Mg2+、SO42-,不能确定的为K+、NO3-、Cl-,
故答案为:Al3+、Mg2+、SO42-;K+、NO3-、Cl-;
(5)液中存在的离子为:Al3+、SO42-、Mg2+,已知硫酸钡沉淀为2.33g,则n(SO42-)=$\frac{2.33g}{233g/mol}$=0.01mol,
根据图象可知与Al(OH)3的OH-为:n(OH-)=0.005mol,
Al(OH)3 +OH-=AlO2-+2H2O Mg2++2OH-=Fe(OH)2↓
n(Al3+) 0.005mol n(Mg2+) 0.035-3n(Al3+)
所以n(Al3+)=0.005mol,n(Mg2+)=0.01mol 所以溶液中Mg2+和Al3+所带正电荷与SO42-所带负电荷不相等,加入硝酸酸化,再滴入AgNO3溶液,未见白色沉淀生成,则一定不存在Cl-,因此存在NO3-,
设NO3-物质的量为nmol,根据电荷守恒得:3n(Al3+)+2n(Mg2+)=2n(SO42-)+n(NO3-)所以n(NO3-)=0.015mol,所以c(NO3-)═$\frac{0.015mol}{0.1L}$=0.15mol/L,
故答案为:NO3-;0.15mol/L.
点评 本题考查无机物的推断,为高频考点,侧重于学生的分析、计算能力的考查,关键是图象分析离子特征和离子共存的判断,题目难度中等.


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①④⑥ | C. | 只有③ | D. | 只有⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/浓度 | c(NH3)(mol/L) | C(O2)(mol/L) | C(NO)(mol/L) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.8 | 0.975 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ |
 |  |  |  |
| 防治高血压 | 防治缺铁性贫血 | 做甜味剂 | 做防腐剂 |
| A. | ① | B. | ② | C. | ③ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2属于危险化学品,其标识应为: | |
| B. | 当你走进化学实验室之前,应认真阅读实验室的安全守则 | |
| C. | 中国大陆的火警报警电话为“119”,香港、澳门为“999” | |
| D. | 一般情况下,金属类物质着火时不宜使用二氧化碳类灭火器 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com