
| A. |  萃取分离 | B. |  转移溶液 | C. |  量取液体 | D. |  称取NaOH固体 称取NaOH固体 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | K+、Cu2+、NO3-、SO42- | B. | K+、H+、SO42-、OH- | ||
| C. | Al3+、NH4+、OH-、Cl- | D. | Ca2+、Na+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ca2+ | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有$S{O}_{4}^{2-}$ | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中溶液变浑浊,一定有$C{O}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用电泳现象区别溶液和胶体 | |
| B. | 用渗析的方法除去胶体中的离子或分子,以净化胶体 | |
| C. | 用滤纸过滤除去溶液中的胶体粒子 | |
| D. | 向新制Fe(OH)3胶体中加入足量AgNO3溶液,以除去胶体中的Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
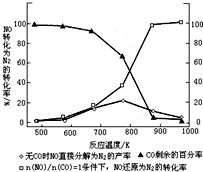 乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
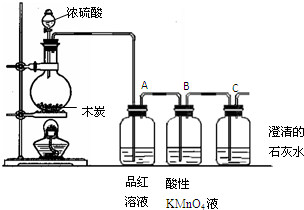
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | X | Y | Z | W |
| 原子半径(nm) | 0.077 | 0.075 | 0.102 | 0.099 |
| 最高正价或最低负价 | +4 | +5 | -2 | -1 |
| A. | X、Y、Z、W四种元素的单质均为分子晶体 | |
| B. | X、Y、Z、W四种元素的电负性:Y>X>W>Z | |
| C. | X与Z形成XZ2,其空间构型为直线型 | |
| D. | Y的氢化物与W的氢化物相互反应的产物只含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com