
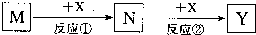
| A. | M:MaOH X:CO2 | B. | M:HNO3 X:Fe | C. | M:S X:O2 | D. | M:Al X:NaOH |
分析 A.氢氧化钠可与二氧化碳反应生成碳酸钠、碳酸氢钠;
B.硝酸与铁反应生成硝酸铁,硝酸铁与铁反应生成亚铁;
C.硫与氧气反应生成二氧化硫,二氧化硫和氧气在催化作用下反应生成三氧化硫;
D.氯与氢氧化钠反应生成偏铝酸钠.
解答 解:A、M:NaOH,X:CO2 存在转化关系:NaOH$\stackrel{CO_{2}}{→}$Na2CO3$\stackrel{CO_{2}}{→}$NaHCO3,符合转化关系,故A不选;
B、M:HNO3,X:Fe存在转化关系HNO3$\stackrel{Fe}{→}$Fe3+$\stackrel{Fe}{→}$Fe2+,符合转化关系,故B不选;
C、M:S,X为O2存在转化关系,S$\stackrel{O_{2}}{→}$SO2$\stackrel{O_{2}}{→}$SO3,符合转化关系,故C不选;
D、M:Al,X:NaOH存在转化关系:Al$\stackrel{NaOH}{→}$NaAlO2,不能继续和氢氧化钠溶液反应,故D选;
故选D.
点评 本题考查了物质转化关系的应用,物质性质的应用,主要考查碳、硫、铝、铁及其化合物的性质应用,题目难度中等.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:解答题
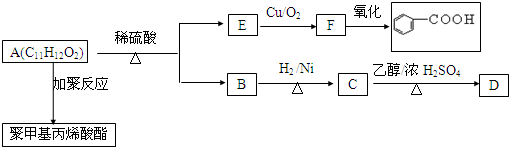
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
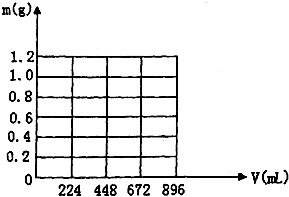 将KOH和Ca(OH)2混合物1.86g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体.当生成沉淀的质量刚好最大时,消耗CO2的体积为224mL(标准状况,忽略CO2溶于水情况,以下情况相同.)
将KOH和Ca(OH)2混合物1.86g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体.当生成沉淀的质量刚好最大时,消耗CO2的体积为224mL(标准状况,忽略CO2溶于水情况,以下情况相同.)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
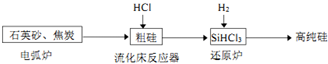
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙二酸二乙酯、乙二酸乙二酯、二乙酸乙二酯它们互为同分异构体 | |
| B. | 用氢氧化铁胶体进行电泳实验时,阴极区域颜色加深,说明氢氧化铁胶体带正电荷 | |
| C. | 含Fe元素的质量分数为70%的铁红一定是纯净物 | |
| D. | 在干冰晶体中,每个CO2分子周围与之最接近而且距离相等的CO2分子有6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气跟烧碱溶液反应:Cl2+OH-═Cl-+HClO | |
| B. | 漂白粉溶液中通入足量的SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 明矾溶液与氢氧化钡溶液反应,使SO42-恰好完全沉淀:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| D. | 将氯气通入氯化亚铁溶液中:Fe2++Cl2═Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可燃冰是可以燃烧的冰 | |
| B. | 明矾的化学式:KAl(SO4)2 | |
| C. | 酒精、水玻璃、福尔马林都是非电解质 | |
| D. | 肽键是蛋白质一级结构中的主键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其他 | 常温下该单质为黄色固体 | 无机非金属材料的主角 | 焰色反应呈黄色 | 其氧化物可做耐火材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
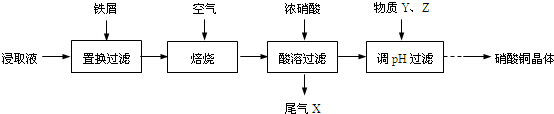
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com