
| A. | C2H2、C2H4 | B. | C2H4、C3H6 | C. | C2H6、C3H8 | D. | CH4、C2H2 |
分析 各选项中烃的混合物,只要总质量一定,无论按什么比例混合,完全燃烧后生成的CO2和H2O都是恒量,说明混合物中C、H的含量相同,则各烃的最简式相同,据此进行解答.
解答 解:A.C2H2最简式为CH,C2H4的最简式为CH2,二者最简式不同,故A错误;
B.C2H4的最简式为CH2,C3H6最简式为CH2,二者最简式相同,故B正确;
C.C2H6的最简式为CH3,C3H8最简式为C3H8,二者最简式不同,故C错误;
D.CH4最简式为CH4,C2H2的最简式为CH,二者最简式不相同,故D错误;
故选B.
点评 本题考查化学方程式的计算、混合物反应的计算,题目难度中等,明确“质量一定的混合烃燃烧生成CO2和H2O是恒量,满足最简式相同”的含义为解答关键,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
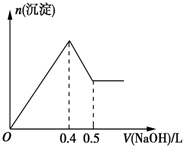 现有AlCl3和MgSO4混合溶液,向其中不断加入0.1mol/L的NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )
现有AlCl3和MgSO4混合溶液,向其中不断加入0.1mol/L的NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )| A. | 6:1 | B. | 2:3 | C. | 1:3 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
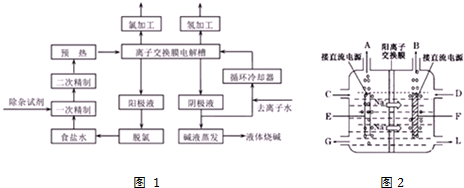
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
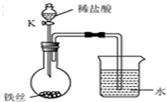 水是最普通、最常见的物质之一.
水是最普通、最常见的物质之一.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L乙醇所含的分子数为NA | |
| B. | 1mol/LCaCl2溶液中含有的氯离子数目为2NA | |
| C. | 1 mol金属钠在足量乙醇完全反应转移的电子数为2NA | |
| D. | 1.6g 甲烷中含有的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
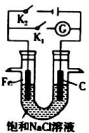 将铁棒和石墨棒插入盛有饱和NaCl溶液的U形管中形成如图装置:
将铁棒和石墨棒插入盛有饱和NaCl溶液的U形管中形成如图装置:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO>H2SO4>H2CO3; 非金属性Cl>S>C | |
| B. | 碱性:CsOH>KOH>Mg(OH)2>NaOH; 金属性:Cs>K>Mg>Na | |
| C. | 稳定性:HF>H2O>NH3>CH4; 还原性:CH4>NH3>H2O>HF | |
| D. | 离子半径:Na+>Mg2+>Al3+>Cl-; 原子半径:Na>Mg>Al>Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com