
【题目】取一定量的Na2CO3、NaHCO3和Na2SO4混合物与250mL 1.00molL﹣1过量盐酸反应,生成2.016L CO2(标准状况),然后加入500mL 0.100molL﹣1Ba(OH)2溶液,得到沉淀的质量为2.33g,溶液中过量的碱用10.0mL 1.00mlL﹣1盐酸恰好完全中和.计算:
(1)混合物中Na2SO4的质量;
(2)混合物中Na2CO3的物质的量.
【答案】
(1)解:加入氢氧化钡溶液后生成的沉淀为硫酸钡,根据硫酸根离子守恒可知:混合物中Na2SO4的质量= ![]() ×142g/mol=1.42g,
×142g/mol=1.42g,
答:混合物中含有硫酸钠的质量为1.42g;
(2)解:设混合物中NaCO3和NaHCO3的物质的量分别为x和y,反应中放出的CO2物质的量= ![]() =0.090mol,
=0.090mol,
根据碳原子守恒可知:①x+y=0.09mol,
与Na2CO3、NaHCO3反应的盐酸的物质的量为:1.0mol/L×0.25L+1mol/L×0.01L﹣0.1mol/L×0.5L×2=0.16mol,
则:②2x+y=0.16mol,
根据①②解得:x=0.07mol、y=0.02mol,
即:混合物中含有碳酸钠的物质的量为0.07mol,
答:混合物中含有0.07mol碳酸钠.
【解析】(1)生成的2.33g沉淀为硫酸钡,根据硫酸根离子守恒可计算出原混合物中硫酸钠的物质的量、质量;(2)根据消耗的盐酸、氢氧化钡的物质的量计算出碳酸钠、碳酸氢钠消耗的氯化氢的物质的量,然后根据生成的二氧化碳、消耗的氯化氢的量分别列式计算出碳酸钠的物质的量.


科目:高中化学 来源: 题型:
【题目】已知X、Y、Z三元素的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。C、D是由X、Y、Z中两种元素组成的化合物,C通常状况下为无色液体, D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷电路板。各物质之间的转换关系如下图,部分生成物省略。请回答下列问题:
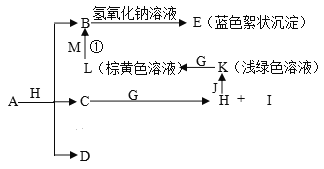
(1)写出A的化学式__________________,C的电子式______________________,
D的结构式______________________________。
(2)将22.4L(标准状况)D气体通入1L 1mol/L NaOH溶液中,完全吸收后,溶液中除了Na+外,还大量存在的离子是______________________________。
(3)已知M溶于稀硝酸,溶液变成蓝色,并放出无色气体。请写出该反应的离子方程式___________________________________________________________。
(4)检验化合物K中阳离子的实验方法是______________________________________
(5)写出反应K+G→L的化学方程式是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是( )

①CO、O2 ②Cl2、CH4 ③NO2、O2 ④N2、H2
A. ①② B. ②④ C. ③④ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素原子半径与原子序数的关系图。字母代表元素,分析正确的是
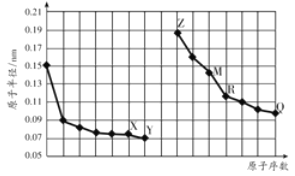
A. R在周期表的第15列
B. Y、Q两种元素的气态氢化物及其最高价氧化物的水化物均为强酸
C. 简单离子的半径:X>Z>M
D. Z的单质能从M与Q元素构成的盐溶液中置换出单质M
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明代《本草纲目》中一条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指
A.蒸馏B.渗析C.萃取D.干馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是( )
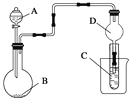
A. 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B. 若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
C. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解
D. 若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含少量镁粉的铝粉制取纯净的氢氧化铝,下列操作步骤中最恰当的组合是( )
①加盐酸溶解 ②加烧碱溶液溶解 ③过滤 ④通入过量CO2生成Al(OH)3沉淀 ⑤加入盐酸生成Al(OH)3沉淀 ⑥加入过量烧碱溶液
A.②③④③B.①⑥⑤③C.②③⑤③D.①③⑤③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(O=C=S)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。羰基硫的氢解反应和水解反应是两种常用的脱硫方法,其反应式分别为:
①氢解反应:COS(g)+H2(g)![]() H2S(g)+CO(g) △H1=+7kJ/mol
H2S(g)+CO(g) △H1=+7kJ/mol
②水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H2
H2S(g)+CO2(g) △H2
已知反应中相关的化学键键能数据如下:
化学键 | C=O(CO2) | C=O(COS) | C=S | H-S | H-O |
E/kJ·mol-1 | 803 | 742 | 577 | 339 | 465 |
回答下列问题:
(1)在以上脱除COS的反应中,若某反应有1mol电子发生转移,则该反应吸收的热量为____kJ。
(2)已知热化学方程式CO(g)+H2O(g)![]() H2(g)+CO2(g) △H3,则△H3=_____kJ/mol。
H2(g)+CO2(g) △H3,则△H3=_____kJ/mol。
(3)某温度下,在某密闭容器中进行COS的氢解反应
①当反应达到限度后,增大容器的体积,则正反应速率_____(填“增大”“减小”或“不变”);
②当容器体积不变时,若起始时充入COS和H2的体积比为1:2,下列情形能表明反应达到平衡状态的是______。
a.气体密度不变 b.COS与H2浓度比不变
c.混合气体的平均相对分子质量不变 d.COS体积分数不变
③当容器体积不变时,若COS和H2的起始物质的量比为1:a,平衡后COS和H2的物质的量比为1:10a,则此温度下H2平衡转化率为______(用含a的式子表示)。
(4)羰基硫的氢解或水解反应能否设计成原电池_____(能或否),理由是________。
(5)用金属储氢材料(MH)、铂(Pt)、硫酸溶液组成的原电池可以使羰基硫脱硫处理。
①原电池的负极材料是____(填化学式)。
②写出原电池的正极反应式_________,正极周围溶液pH______(填“增大”“减小”或“不变”)。
③原电池工作时,硫酸溶液的作用是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com