
下列实验方案不可行或结论不正确的是( )
A.用润湿的pH试纸测定饱和Na2CO3溶液的pH
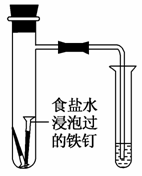
B.通过观察右图中导管水柱的变化,验证铁钉生锈的原因主要是吸氧腐蚀
C.向Mg(OH)2悬浊液中滴加FeCl3溶液,出现红褐色沉淀,说明溶解度:Fe(OH)3<Mg(OH)2
D.向同pH、同体积的醋酸和盐酸溶液中加入足量Zn粒,通过完全反应后收集到的H2体积比较两种酸的电离程度:醋酸<盐酸
科目:高中化学 来源: 题型:
铝是一种重要的金属,在生产、生活中具有许多重要的用途,下图是从铝土矿中制备铝的工艺流程:
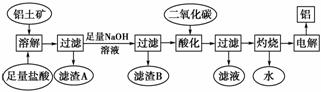
已知: 铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;回答下列问题:
(1)向铝土矿中加入足量盐酸过滤后所得滤渣A的主要成分为________。
(2)在工艺流程中,加入足量氢氧化钠溶液过程中发生反应的离子方程式为__________________________________________________________________________,
过滤后所得滤渣B的成分为________。用二氧化碳酸化后过滤所得滤液中的溶质是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,正确的是( )
|
| A. | 由同种元素组成的物质肯定属于纯净物 |
|
| B. | 一种元素可形成多种离子,但只能是带同种电荷的离子 |
|
| C. | 含金属元素的离子不一定都是阳离子 |
|
| D. | 具有相同质子数的粒子都属于同种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中正确的是( )
|
| A. | NH4HCO3溶液与过量NaOH溶液反应:NH4++OH﹣→NH3↑+2H2O |
|
| B. | 向FeBr2溶液中通入Cl2,当n(FeBr2)=n(Cl2)时:2Fe2++4Br﹣+3Cl2→2Fe3++2Br2+6Cl﹣ |
|
| C. | 向FeI2溶液中通入Cl2,当n(FeI2):n(Cl2)=1:1时:2I﹣+Cl2→I2+2Cl﹣ |
|
| D. | 向烧碱溶液中通入CO2,当n(NaOH):n(CO2)=3:2时:OH﹣+CO2→HCO3﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验操作或判断不正确的是 (填序号).
A.配制一定物质的量浓度溶液,定容时平视刻度线.
B.苯、四氯化碳、乙醇三种有机溶剂都可用来萃取溴水中的溴.
C.让一束光通过胶体,从垂直于光线的方向可以看到一条光亮的“通路”.
D.配制100mL1mol/L的NaOH溶液,需称量4g的氢氧化钠固体.
E.用铂丝蘸取少量溶液做焰色反应,没有观察到紫色,所以该溶液中不含钾元素.
查看答案和解析>>
科目:高中化学 来源: 题型:
柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:
FeSO4+Na2CO3===FeCO3↓+Na2SO4
FeCO3+C6H8O7===FeC6H6O7+CO2↑+H2O
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
(1)制备FeCO3时,选用的加料方式是________(填字母,)原因是________________________________________________________________________。
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是________________________________________________________________________________________________________________________________________________。
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80 ℃下搅拌反应。
①铁粉的作用是______________________________________________ _____________________。
②反应结束后,无需过滤,除去过量铁粉的方法是________________________________________________________________________________________________________________________________________________。
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。分离过程中加入无水乙醇的目的是________________________________________________________________________。
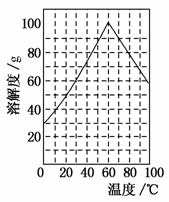
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备绿矾,再合成柠檬酸亚铁。请结合上图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4·7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应,__________________________________________________________________________________________________________________________________,得到FeSO4溶液,_________________________________ _____________________________________________,得到FeSO4·7H2O晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)
___________________________________________________________。
(2)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式)________________。
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系:
A B(在水溶液中进行)
B(在水溶液中进行)
其中,C是溶于水显酸性的气体;D是淡黄色固体。
写出C的结构式:_____________________________________________ ________________________;
D的电子式:________________。
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为____________________________;由A转化为B的离子方程式为________________________________________________________________________。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因:______________________。A、B浓度均为0.1 mol·L-1的混合溶液中,离子浓度由大到小的顺序是____________________________________;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。
已知:3I2+6OH—=IO3—+5I—+3H2O。下列说法不正确的是
A.右侧发生的电极方程式:2H2O+2e—=H2↑+2OH—
B.电解结束时,右侧溶液中含有IO3—
C.电解槽内发生反应的总化学方程式KI+3H2O= KIO3+3H2↑
D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作正确且能达到预期目的的是
| 实验目的 | 操作 | |
| A | 比较水和乙醇中羟 | 用金属钠分别与水和乙醇反应 |
| B | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液,看紫红色是否褪去 |
| C | 欲分离乙醇中混有的苯酚 | 向混合液中加入过量的NaOH溶液,充分反应后,分液 |
| D | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com