考点:制备实验方案的设计,氧化还原反应的电子转移数目计算,用盖斯定律进行有关反应热的计算,难溶电解质的溶解平衡及沉淀转化的本质,镁、铝的重要化合物,物质的分离、提纯和除杂
专题:化学反应中的能量变化,电离平衡与溶液的pH专题
分析:(1)所含元素化合价降低的反应物是氧化剂;反应中硫单质中硫元素化合价由0价升高为SO2中+4价,硫单质为还原剂,计算生成102gAl2O3需要硫的物质的量,转移电子是硫单质的4倍,再根据N=nNA转移电子数目;
(2)分析流程结合氧化铝的性质可知,沉淀Ⅰ是Al(OH)3;
(3)沉淀Ⅱ是Fe(OH)3;
(4)沉淀Ⅰ是Al(OH)3,证明沉淀Ⅰ已洗涤干净的实验操作是检验洗涤液中师傅汉语硫酸根离子设计实验检验;
(5)从滤液中得到K2SO4晶体的方法是蒸发浓缩,冷却结晶,过滤洗涤得到晶体;
(6)电解时阳极发生反应生成FeO42-,依据化合价的变化和电荷守恒书写电极反应.
解答:
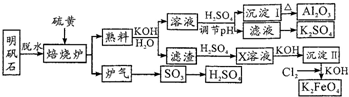
解:利用明矾石(主要成分是K
2SO
4?Al
2(SO
4)
3?2Al
2O
3?6H
2O,此外还含有少量Fe
2O
3杂质)制备Al
2O
3、K
2FeO
4和H
2SO
4的工艺流程:明矾脱水后主要成分是K
2SO
4?Al
2(SO
4)
3?2Al
2O
3,“焙烧”Al
2(SO
4)
3中+6价降低为SO
2中+4价,Al
2(SO
4)
3是氧化剂,硫单质为还原剂,发生2Al
2(SO
4)
3+3S
Al
2O
3+9SO
2,熟料溶解为氧化铝与氢氧化钾溶液反应生成偏铝酸钾,离子方程式为Al
2O
3+2OH
-=2AlO
2-+H
2O,熟料溶解所得的溶液中含有K
+、SO
42-、AlO
2-、OH
-等,加硫酸调PH值,AlO
2-转化为Al(OH)
3,灼烧生成Al
2O
3,母液中离子主要有K
+、SO
42-,含有溶质为K
2SO
4,滤渣为Fe
2O
3,加硫酸Fe
2O
3+3H
2SO
4=Fe
2(SO
4)
3+3H
2O,X为Fe
2(SO
4)
3,加氢氧化钾Fe
2(SO
4)
3+6KOH=2Fe(OH)
3↓+3K
2SO
4,通入氯气:2Fe(OH)
3+3Cl
2+10KOH═2K
2FeO
4+6KCl+8H
2O,制得K
2FeO
4;
(1)“焙烧”Al
2(SO
4)
3中+6价降低为SO
2中+4价,Al
2(SO
4)
3是氧化剂,硫单质为还原剂,发生2Al
2(SO
4)
3+3S
Al
2O
3+9SO
2,反应中硫元素化合价由Al
2(SO
4)
3中+6价降低为SO
2中+4价,反应中硫单质中硫元素化合价由0价升高为SO
2中+4价,氧化剂与还原剂的物质的量之比是2:1;生成102gAl
2O
3的物质的量为n=
=
=1mol,需要硫的物质的量为1mol×
=1.5mol,转移电子的物质的量为1.5mol×4=6mol,转移电子数目为N=nN
A=6mol×N
Amol
-1=6N
A,
故答案为:2Al
2(SO
4)
3+3S
Al
2O
3+9SO
2;6N
A;
(2)分析流程结合氧化铝的性质可知,铝土矿中的氧化铝和氢氧化钠反应生成偏铝酸钠,氧化铁不和氢氧化钠溶液反应过滤得到滤渣为氧化铁,熟料溶解为氧化铝与氢氧化钾溶液反应生成偏铝酸钾,离子方程式为Al
2O
3+2OH
-=2AlO
2-+H
2O,熟料溶解所得的溶液中含有K
+、SO
42-、AlO
2-、OH
-等,加硫酸调PH值,AlO
2-转化为Al(OH)
3,沉淀Ⅰ是Al(OH)
3,反应的离子方程式为:AlO
2-+H
++H
2O=Al(OH)
3↓;
故答案为:AlO
2-+H
++H
2O=Al(OH)
3↓;
(3)滤渣为Fe
2O
3,加硫酸Fe
2O
3+3H
2SO
4=Fe
2(SO
4)
3+3H
2O,X为Fe
2(SO
4)
3,加氢氧化钾Fe
2(SO
4)
3+6KOH=2Fe(OH)
3↓+3K
2SO
4,沉淀Ⅱ是Fe(OH)
3;
故答案为:Fe(OH)
3;
(4)溶液经加硫酸调节pH后,过滤,洗涤,可得沉淀Ⅰ,证明沉淀Ⅰ已洗涤干净的实验操作和现象是:取最后一次洗涤液于试管中,滴加BaCl
2溶液,若无白色沉淀生成,则已将沉淀洗干净;
故答案为:取最后一次洗涤液于试管中,滴加BaCl
2溶液,若无白色沉淀生成,则已将沉淀洗干净;
(5)从滤液中得到K
2SO
4晶体的方法是蒸发浓缩,冷却结晶,过滤洗涤得到晶体,故答案为:蒸发结晶;
(6)阳极是铁失电子在碱性溶液中发生氧化反应生成FeO
42-;电极反应为Fe+8OH
--6e
-=FeO
42-+4H
2O,故答案为:Fe+8OH
--6e
-=FeO
42-+4H
2O.
(2)Al(OH)
3(1分)Fe(OH)
3(1分)
(3)Al
2O
3+2OH
-=2AlO
2-+H
2O(2分)
(4)取最后一次洗涤的滤液于试管中,滴加BaCl
2溶液,若无白色沉淀生成则已洗涤干净.2分)
(5)2Fe(OH)
3+3Cl
2+10 KOH═2K
2FeO
4+6KCl+8H
2O(2分)
(6)Fe+8OH
--6e
-=FeO
42-+4H
2O (2分)
(7)SO
3(g)+H
2O(l)=H
2SO
4 (l)△H
3=-130 kJ?mol
-1(2分)
(8)H
2SO
4(1分)
点评:点评:本题以铝、铁的化合物为载体考查了物质间的反应、物质的分离和电解等知识点,明确物质之间的反应是解本题关键,这种综合性较强的题型是高考热点,须利用基础知识细心分析解答,题目难度中等.



 )合成Lexan聚碳酸酯(一种高强材料,可用于制作防弹窗户).写出此合成反应的化学方程式:
)合成Lexan聚碳酸酯(一种高强材料,可用于制作防弹窗户).写出此合成反应的化学方程式: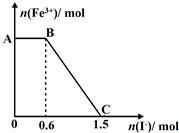 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( ) 、PTT和DAP等化工产品.
、PTT和DAP等化工产品.
 直接反应,原因是
直接反应,原因是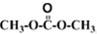 )发生酯交换反应,生成一种高分子化合物M和甲醇,写出M的结构简式
)发生酯交换反应,生成一种高分子化合物M和甲醇,写出M的结构简式