
【题目】明矾[ KAl(SO4)2·12H2O ]在造纸、净水等方面应用广泛。以处理过的废旧易拉罐碎屑为原料(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。
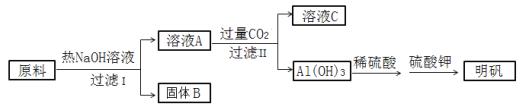
回答下列问题:
(1)KAl(SO4)2的电离方程式______________________________。
(2)原料溶解过程中反应的离子方程式是___________________________________。
(3)明矾溶液与过量的Ba(OH)2溶液反应的离子方程式是______________________________。
(4)溶液A中通入过量CO2,反应的化学方程式是_____________________________________。
(5)为证明固体B中含有铁,某同学做如下实验:取少量固体B,加入稀硫酸使其溶解,观察到有无色气体生成。向溶液中加入__________和__________,溶液立即变红,证明固体B中含有铁。
【答案】KAl(SO4)2=K++Al3++2SO42- 2Al+2OH-+2H2O=2AlO2-+3H2↑ Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4+2H2O NaAlO2+2H2O+ CO2=Al(OH)3+NaHCO3 硫氰化钾溶液 氯水或双氧水
【解析】
原料中的Al可与NaOH反应生成偏铝酸钠,则固体B为Fe、Mg杂质;偏铝酸钠与过量的二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠溶液,则C为碳酸氢钠溶液。
(1) KAl(SO4)2为盐,属于强电解质,在溶液中完全电离生成钾离子、铝离子和硫酸根离子,电离方程式为KAl(SO4)2=K++Al3++2SO42-;
(2) 原料溶解过程中,Al与NaOH反应生成偏铝酸钠和氢气,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3) 明矾溶液与过量的Ba(OH)2溶液反应生成硫酸钡沉淀、偏铝酸钾和水,反应的离子方程式为Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4+2H2O;
(4)A溶液为偏铝酸钠溶液,通入过量的二氧化碳生成碳酸氢钠和氢氧化铝沉淀,化学方程式为NaAlO2+2H2O+ CO2=Al(OH)3+NaHCO3;
(5)若有Fe时,溶液为硫酸亚铁,则加入KSCN溶液时,溶液无变化,再加入氯气或双氧水,氧化为三价铁离子时溶液变为血红色。


科目:高中化学 来源: 题型:
【题目】二氧化硅又称硅石,是制备硅及含硅化合物的重要原料。部分转化过程如图所示,下列说法正确的是
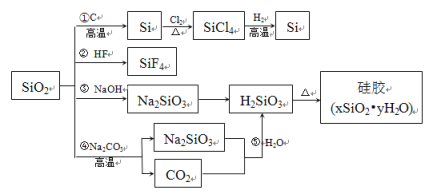
A.SiO2既能发生②反应,又能发生③反应,说明SiO2属于两性氧化物
B.④反应是水泥工业的化学反应原理之一,⑤反应可证明H2CO3酸性强于H2SiO3
C.①反应的生成物除Si外还有CO2,硅胶可用作催化剂的载体
D.除了粗硅的制备和提纯过程中涉及的反应外,图中所示其他反应都是非氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(N2H4)常温下为无色液体,可用作火箭燃料。下列说法不正确的是
①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)= N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2 N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4=1048.9 kJ·mol-1
A.ΔH4﹦2ΔH32ΔH2ΔH1
B.O2(g)+2H2(g)![]() 2H2O(l) ΔH5,ΔH5>ΔH3
2H2O(l) ΔH5,ΔH5>ΔH3
C.1 mol O2(g)和 2 mol H2(g)具有的总能量高于 2 mol H2O(g)
D.联氨和 N2O4 作火箭推进剂的原因之一是反应放出大量的热且产物无污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如图所示原电池的叙述,正确的是(盐桥中装有含琼胶的 KCl 饱和溶液)
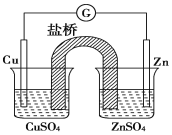
A.正极反应为 Zn- 2e- == Zn2+
B.取出盐桥后,检流计依然发生偏转
C.反应中,盐桥中的 K+会移向 CuSO4 溶液
D.电子从负极流向正极,再经盐桥流回负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为铅蓄电池的示意图。下列说法正确的是
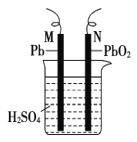
A.放电时,N 为负极,其电极反应式为 PbO2+SO42—+4H++2e-=PbSO4+2H2O
B.放电时,c(H2SO4)不变
C.充电时,阳极反应式为 PbSO4+2e-=Pb+SO42-
D.充电时,若 N 连电源正极,则该极生成 PbO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作及装置正确的是
A.配制一定物质的量浓度的 NaOH溶液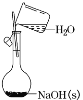
B.比较 NaHCO3和 Na2 CO3 的热稳定性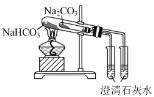
C.制取并观察 Fe(OH)2沉淀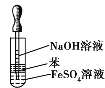
D.蒸馏海水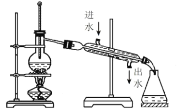
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】秋冬季是雾霾高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的主要原因之一。
(1)工业上利用甲烷催化还原NO,可减少氮氧化物的排放。
已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH=-574kJ·mol1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH=-1160kJ·mol1
甲烷直接将NO2还原为N2的热化学方程式为_____________________________________。
(2)汽车尾气催化净化是控制汽车尾气排放、减少汽车尾气污染的最有效的手段,主要原理为2NO(g)+2CO(g)![]() N2(g)+2CO2(g)ΔH<0
N2(g)+2CO2(g)ΔH<0
T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0~15min)中NO的物质的量随时间变化如上图所示。
①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=20MPa,则T℃时该反应的压力平衡常数Kp=_______;平衡后,若保持温度不变,再向容器中充入NO和CO2各0.3mol,平衡将_____(填“向左”、“向右”或“不”)移动。
②15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是__(填序号)
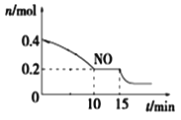
A.增大CO浓度B.升温C.减小容器体积D.加入催化剂
(3)工业上常采用“碱溶液吸收”的方法来同时吸收SO2,和氮的氧化物气体(NOx),如用氢氧化钠溶液吸收可得到Na2SO3、NaHSO3、NaNO2、NaNO3等溶液。已知:常温下,HNO2的电离常数为Ka=7×10-4,H2SO3的电离常数为Ka1=1.2×10-2、Ka2=5.8×10-8。
①常温下,相同浓度的Na2SO3、NaNO2溶液中pH较大的是______溶液。
②常温下,NaHSO3显___性(填“酸”“碱”或“中”,判断的理由是(通过计算说明)_____________。
(4)铈元素(Ce)是镧系金属中自然丰度最高的一种,常见有+3、+4两种价态。雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO2-、NO3-(二者物质的量之比为1∶1)。可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如图所示。
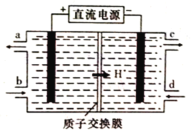
①Ce4+从电解槽的_____(填字母代号)口流出。
②写出阴极的电极反应式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现对冶金硅进行电解精炼提纯可降低高纯硅制备成本。相关电解槽装置如左图,用Cu-Si合金作硅源,在950℃利用三层液熔盐进行电解精炼,并利用某CH4燃料电池(右图)作为电源。有关说法不正确的是

A. 电极c与a相连,d与b相连
B. 左侧电解槽中:Si 优先于Cu被还原,Cu优先于Si被氧化
C. 三层液熔盐的作用是增大电解反应面积,提高硅沉积效率
D. 相同时间下,通入CH4、O2的体积不同,会影响硅提纯速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用甲烷和氧气按9:1的体积比混合,在200℃和10MPa的条件下,通过铜制管道反应制得甲醇:2CH4+O2=2CH3COH。
(1)已知一定条件下,CH4和CH3COH燃烧的热化学方程式分别为:
CH4(g)+SO2(g)=CO2(g)+2H2(g) △H=-802kJ/lmol
CH3OH(g)+l.5O2(g)=CO2(g)+2H2O(g) △H=-677kJ/mol
则2CH4(g)+O2(g)=2CH3OH(g) △H=__________
(2)甲烷固体氧化物燃料电池属于第三代燃料电池,是一种在中高温下直接将储存在燃料和氧化剂中的化学能高效、环境友好地转化成电能的全固态化学发电装置。其工作原理如下图所示。a是电池的____极(填“正”或“负”) ,b极的电极反应式为__________。

(3)工业上合成甲醇的另一种方法为:
CO(g)+2H2(g) ![]() CH3OH(g) △H=-90kJ/mol
CH3OH(g) △H=-90kJ/mol
T℃时,将2mol CO 和4molH2充入1L 的密闭容器中,测得H2的物质的量随时间变化如下图实线所示。
① 能用于判断反应已达化学平衡状态的是____________。
A.气体的总压强不再改变
B. H2与CH3OH的体积比不再改变
C.气体的密度不再改变
D.单位时间内消耗1mol CO,同时生成1mol CH3OH
② 请计算出T℃ 时反应的平衡常数K=_________________。
③ 仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线Ⅰ对应的实验条件改变是:________;曲线Ⅱ对应的实验条件改变是_________0。

④ a、b、c三点逆反应速率由大到小排列的顺序是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com