
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:09~10年石家庄市高一下学期期末考试化学卷 题型:实验题
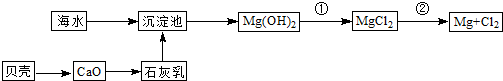
(8分)从海水中可以获得淡水、食盐,并可提取镁和溴等物质。
(一)海水淡化的方法主要有 (填一种)
(二)从海水中提取溴和镁的流程如下图所示: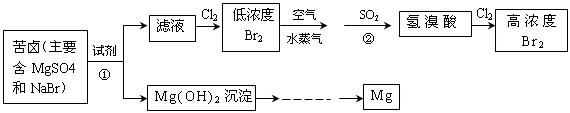
(1)提取Br 时第一次通入Cl
时第一次通入Cl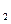 后发生反应的离子方程式是 ;②中表现
后发生反应的离子方程式是 ;②中表现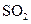 表现 (填“氧化”或“还原”)性;
表现 (填“氧化”或“还原”)性;
第二次通入Cl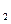 后,要提取Br
后,要提取Br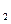 还要进行的操作为 。
还要进行的操作为 。
(2)为了实现对镁离子的富集,①中加入的足量试剂是 (填化学式);
试从节约能源,提高金属镁的纯度分析,以下最适宜的冶炼的方法是 (填字母)。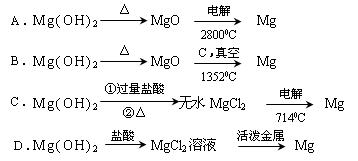
查看答案和解析>>
科目:高中化学 来源:2015届云南省高一下学期期末考试文科化学试卷(解析版) 题型:填空题
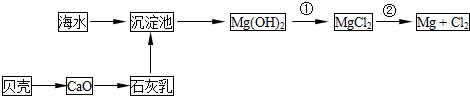
从海水中可以获得淡水、食盐,并可提取镁和溴等物质。
(1)海水淡化的方法主要有______(填一种)。
(2)从海水中提取镁的流程如下图所示:
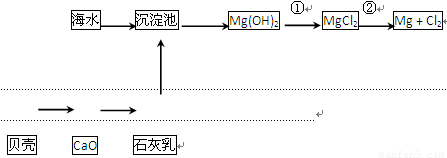
反应①的离子方程式为________________________________________________。
反应②的化学方程式为________________________________________________。
(3)从海水中提取溴的主要步骤是向浓缩的海水中通入氯气,将溴离子氧化,该反应的离子方程式为________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com