
| A. | K+、Ca2+、Cl-、OH- | B. | K+、Na+、Br-、NO3- | ||
| C. | H+、Fe2+、Cl2、SO42- | D. | K+、Ag+、NH3•H2O、CO32- |
分析 A.通入二氧化碳后生成碳酸钙沉淀;
B.四种离子之间不反应,通入二氧化碳后也不反应;
C.氯气能够氧化亚铁离子;
D.银离子与一水合氨按、碳酸根离子反应.
解答 解:A.通入二氧化碳后,Ca2+、OH-与CO2反应生成碳酸钙,通入CO2后不能共存,故A错误;
B.K+、Na+、Br-、NO3-之间不反应,通入CO2后仍能大量共存,故B正确;
C.Fe2+、Cl2之间发生氧化还原反应,在溶液中不能大量共存,故C错误;
D.Ag+与NH3•H2O、CO32-发生反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:选择题
 以甲醇燃料电池(KOH电解质)为电源,在实验室中模拟铝制品表面“钝化”处理的过程.实验中,通电一段时间后可观察到铝电极逐渐失去光泽,并出现细小气泡,装置如图所示,下列说法正确的是( )
以甲醇燃料电池(KOH电解质)为电源,在实验室中模拟铝制品表面“钝化”处理的过程.实验中,通电一段时间后可观察到铝电极逐渐失去光泽,并出现细小气泡,装置如图所示,下列说法正确的是( )| A. | 燃料电池b电极上发生的反应为:CH4O-6e-+H2O═6H++CO2↑ | |
| B. | 电解池中石墨电极做阴极,发生反应为:2H++2e-═H2↑ | |
| C. | 电解池中A1电极上的反应为:Al-3e-+3HCO3-═Al(OH)3↓+3CO2↑ | |
| D. | 理论上毎生成19.5 g沉淀,标准状况下a电极上消耗掉O2 2.1 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,28g N2所含有的原子数为NA | |
| B. | 标准状况下,22.4 LSO3中含有的原子数为4NA | |
| C. | 1L 1.0 mol/L碳酸钠溶液中所含阳离子的数目为2NA | |
| D. | 46gNO2和N2O4的混合气体中含有的氧原子数为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
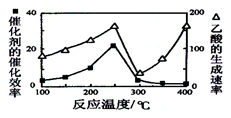
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 《本草纲目》中对“焰硝”(KNO3)的描述为:“火药乃焰硝、硫磺、杉木炭所合,以为烽燧铳机诸药者.”这里体现了KNO3的氧化性 | |
| B. | 《天工开物》中对“膏液”的描述为:“草木之实,其中蕴藏膏液,而不能自流、假媒水火,凭藉木石,而后倾注而出焉.”这里的“膏液”的主要成分为油脂 | |
| C. | 《泉州府志》物产条记载:“初,人不知盖泥法,元时南安有黄长者为宅煮糖,宅垣忽坏,去土而糖白,后人遂效之.”该段文字记载了蔗糖的分离提纯采用了黄泥来吸附红糖中的色素 | |
| D. | 《抱朴子》中记载:“丹砂烧之成水银,积变又成丹砂.”这里是指加热时丹砂(HgS)熔融成液态,冷却时重新结晶为HgS晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,将pH=3的盐酸和pH=5的硫酸等体积混合,所得溶液的pH=4 | |
| B. | 电解质溶液导电时必将发生氧化还原反应,电解过程是将电能转化为化学能 | |
| C. | 电解氯化镁饱和溶液,可制得金属镁 | |
| D. | 铅蓄电池在放点和充电时电池内硫酸的质量分数均变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含0.1 mol Na2O2的晶体中阳离子与阴离子总数为0.4NA | |
| B. | 46 g NO2和N2O4的混合气体中含有的氧原子数为2NA | |
| C. | 1 mol Fe与一定量硝酸恰好完全反应时,转移电子数一定为3NA | |
| D. | 1 mol CH4与过量氯气发生取代反应,生成CH3Cl气体的体积约为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
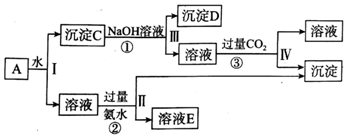
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com