
【题目】化学镀是指使用合适的还原剂,使镀液中的金属离子还原成金属而沉积在镀件表面上的一种镀覆工艺。化学镀广泛用作金属、塑料、玻璃、陶瓷等许多材料的装饰和防护。在ABS工程塑料表面进行化学镀镍的流程如下:
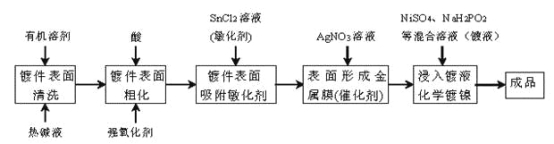
回答下列问题:
(1)化学镀与电镀比较,优点之一是_________。
(2)镀件表面用热碱液清洗的作用是_________,镀件表面粗化的目的是增强亲水性及_________。
(3)镀件浸入AgNO3溶液后,镀件表面吸附的SnCl2将AgNO3还原生成有催化活性的金属银,反应的化学方程式是_________。
(4)镀镍时,镀液中的Ni2+与H2PO2-在催化表面上反应沉积镍,同时生成中强酸H3PO3及与金属镍物质的量相等的氢气,该反应的离子方程式是_________。
(5)化学镀某种金属时,反应时间与镀层厚度的实验数据记录如下表所示:

由此推断,镀层厚度y与反应时间t的关系式为_________;欲使镀层厚度为6anm,需要的反应时间为_________。
(6)化学镀镍废液中含有Ni2+等污染物,需转化为沉淀除去。已知25℃,Ksp[Ni(OH)2]=2.0×10-15。若加入碱后使废液的pH=10,则处理后的废液中镍元素的含量为_________mg·L-1。
【答案】不需通电(或操作简单或镀层厚度、质量均一等) 除去镀层表面油污 增大接触面积 2SnCl2+4AgNO3=4Ag+SnCl4+Sn(NO3)4 Ni2++2H2PO2-+2H2O=Ni+H2↑+2H3PO3 y=at1/2 36s 1.18×10-2
【解析】
(1)化学镀与电镀比较,优点是:化学镀工艺中不需外加电源,而电镀需要电源;且化学镀操作简单、镀层厚度、质量均一;
(2)碱与油脂发生水解反应,洗去油污,所以镀件表面用热碱溶液清洗的目的是除去表面的油污;镀件表面粗化,可以增大与反应物的接触面积,加快反应速率;
(3)SnCl2与硝酸银发生氧化还原反应,生成单质银,说明硝酸银作氧化剂,则SnCl2被氧化为+4价Sn,根据得失电子守恒、原子守恒,反应的化学方程式是2SnCl2+4AgNO3=4Ag+SnCl4+Sn(NO3)4;
(4)根据题意,镀镍时,镀液中的Ni2+与H2PO2-在催化表面上反应沉积镍,同时生成中强酸H3PO3、及与Ni物质的量相等的氢气,离子方程式是Ni2++2H2PO2-+2H2O=Ni+H2↑+2H3PO3;
(5)从表中数据分析,镀层厚度系数的平方与时间相同,所以y=at1/2;若y=6anm,则t=36s;
(6)加入碱后废液的pH=10,则氢氧根离子的浓度为10-4mol/L,根据Ni(OH)2的溶度积可知,镍离子的浓度为2.0×10-15÷(10-4)2=2.0×10-7(mol/L),则处理后的废液中镍元素的含量为2.0×10-7mol/L×59g/mol=1.18×10-2mg/L。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的
A.甲烷的燃烧热为-890 kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+ 2H2O(g)△H=-890 kJ/mol
B.在一定条件下将1 molSO2和0.5molO2置于密闭容器中充分反应,放出热量79.2kJ,则反应的热化学方程式为:2SO2(g)+O2(g)![]() 2SO3(g) △H=-158.4kJ·mol-1
2SO3(g) △H=-158.4kJ·mol-1
C.NaOH(s)+1/2H2SO4(浓)=1/2Na2SO4(aq)+H2O(l) △H=-57.3kJ·mol-1
D.2.00gC2H2气体完全燃烧生成液态水和二氧化碳气体放出99.6kJ的热量,该反应的热化学方程式为:2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2589.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种优良的消毒剂,常将其制成NaClO2固体,以便运输和贮存,过氧化氢法备NaClO2固体的实验装置如图所示。
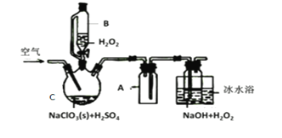
已知:①2NaC1O3+H2O2+H2SO4=2C1O2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
②ClO2熔点-59℃、沸点11℃,浓度过高时易发生分解;
③H2O2沸点150℃
(1)冰水浴冷却的目的是___。
(2)空气流速过快或过慢,均降低NaClO2产率,试解释其原因,空气流速过慢时,__。
(3)Cl-存在时会催化ClO2的生成。反应开始时在C中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步完成,请将其补充完整:
①___(用离子方程式表示)②H2O2+Cl2=2Cl-+O2+2H+
(4)NaClO2纯度测定:
①准确称取所得NaClO2样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的产物为Cl-),将所得混合液配成250mL待测溶液;
②取25.00mL待测液,用2.0mol·L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为__,重复滴定3次,测得Na2S2O3标准液平均用量为20.00mL,则该样品中NaClO2的质量分数为___。(M(NaClO2)=90.5g/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是火箭发动机的燃料,它与N2O4反应时,N2O4为氧化剂,生成氮气和水蒸气。已知:①N2(g)+2O2(g)=N2O4(g)ΔH=+8.7kJ·mol-1;②N2H4(g)+O2(g)=N2(g)+2H2O(g)ΔH=-534.0kJ·mol-1;下列表示肼跟N2O4反应的热化学方程式正确的是
A.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)ΔH=-542.7kJ·mol-1
B.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)ΔH=-1059.3kJ·mol-1
C.N2H4(g)+![]() N2O4(g)=
N2O4(g)=![]() N2(g)+2H2O(g)ΔH=-1076.7kJ·mol-1
N2(g)+2H2O(g)ΔH=-1076.7kJ·mol-1
D.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)ΔH=-1076.7kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X由三种元素组成,为探究其组成的性质,设计并完成如下实验:
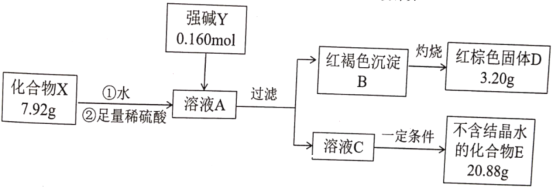
提示:化合物E的焰色反应为紫色(透过蓝色钴玻璃)
请回答:
(1)X的化学式是________________。强碱Y的电子式为________________。
(2)在常温和干燥的条件下,化合物X可以稳定存在,但它在水溶液中不稳定,一段时间后转化为红褐色沉淀和一种气体单质。
①化合物X与水反应的离子方程式为________________。
②人们针对化合物X的稳定性进行了大量的研究,并取得了一定的进展。下列物质可以提高化合物X在水溶液中稳定性的是________________。
A KHSO4 B K2CO3 C CH3COOK D K2SO3
③为研究温度对化合物X水溶液稳定性的影响,请设计一个实验方案:________________________________________________。
(3)化合物X有多种制备方法其中一种方法是在强碱Y条件下用次氯酸钾与红褐色沉淀B反应,其化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化铝钠![]() 是有机合成中的重要还原剂,其合成路线如图所示。
是有机合成中的重要还原剂,其合成路线如图所示。
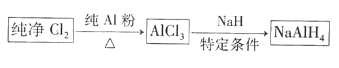
某实验小组利用如图所示的装置制备无水![]() 。
。

(1)装置F的作用是 _____________________________ 。
(2)![]() 与NaH反应时,需将
与NaH反应时,需将![]() 溶于有机溶剂,再将得到的溶液滴加到NaH粉末上,此反应中NaH的转化率较低的原因可能是 _____________________________
溶于有机溶剂,再将得到的溶液滴加到NaH粉末上,此反应中NaH的转化率较低的原因可能是 _____________________________
(3)利用氢化铝钠遇水反应生成的氢气的体积测定氢化铝钠样品的纯度。
①其反应的化学方程式为 _____________________________
②设计如图四种装置测定氢化铝钠样品的纯度(假设杂质不参与反应)。
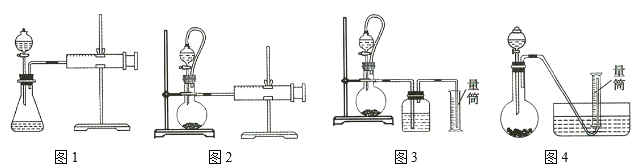
从简约性、准确性角度考虑,最适宜的装置是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA。下列说法正确的是( )
A.1 L 0.1 mol·![]() NH4Cl溶液中,NH4+的数量为0.1NA
NH4Cl溶液中,NH4+的数量为0.1NA
B.2.4g镁在足量的O2中燃烧,转移的电子数为0.1NA
C.标准状况下,5.6 L CO2气体中含有的氧原子数为0.5NA
D.1 mol N2与3 mol H2反应生成的NH3分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W、N的原子序数依次增大,X的原子在元素周期表中原子半径最小,Y的次外层电子数是其电子总数的1/4,离子化合物ZX2是一种储氢材料,W与Y属于同一主族,NY2是医学上常用的水消毒剂、漂白剂。下列叙述正确的是 ( )
A.Y和W分别与X形成的简单化合物的热稳定性:X2 Y > X2W
B.离子半径由大到小的顺序为Y2-< Z2+< N-< W2-
C.ZX2和NY2中含有化学键一致,且微粒个数之比均为1 : 2
D.含氧酸的酸性N > W,可证明非金属性:N > W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电解法处理含![]() 的废水,探究不同因素对含
的废水,探究不同因素对含![]() 废水处理的影响。结果如表所示(
废水处理的影响。结果如表所示(![]() 的起始浓度、体积、电压、电解时间均相同)。下列说法错误的是 ( )
的起始浓度、体积、电压、电解时间均相同)。下列说法错误的是 ( )
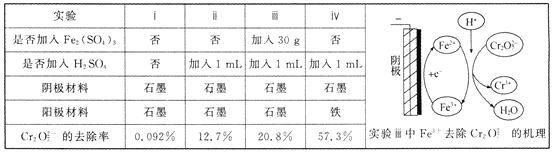
A.实验ⅱ与实验ⅰ对比,其他条件不变,增加c(H+)有利于![]() 的去除
的去除
B.实验ⅲ与实验ⅱ对比,其他条件不变,增加c(Fe3+)有利于![]() 的去除
的去除
C.实验ⅲ中Fe3+循环利用提高了![]() 的去除率
的去除率
D.若实验iV中去除0.0l mol ![]() ,电路中共转移0.06 mol电子
,电路中共转移0.06 mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com