
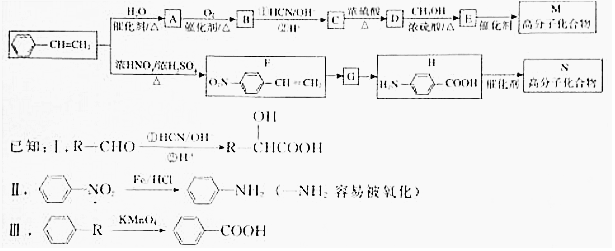
 .
.  →F的反应类型为取代 反应.
→F的反应类型为取代 反应.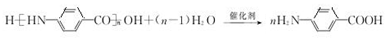 .
.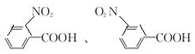 .
.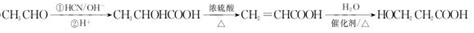 .
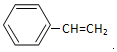
. 分析 根据题中各物质转化关系,苯乙烯与水加成生成A为 ,
, 发生氧化反应生成B为
发生氧化反应生成B为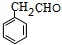 ,
, 发生信息Ⅰ中 的反应生成C
发生信息Ⅰ中 的反应生成C ,
, 在浓硫酸作用下发生消去反应得D为
在浓硫酸作用下发生消去反应得D为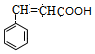 ,
,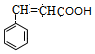 与甲醇发生酯化得E为
与甲醇发生酯化得E为 ,
, 发生加聚反应得M为
发生加聚反应得M为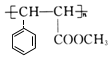 ,比较F和H的结构可知,F发生信息Ⅲ中的反应生成G为
,比较F和H的结构可知,F发生信息Ⅲ中的反应生成G为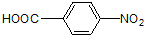 ,H发生缩聚反应生成N为
,H发生缩聚反应生成N为 ,以CH3CHO为原料制备HOCH2CH2COOH,可以将CH3CHO发生信息Ⅰ中的反应生成CH3CHOHCOOH,再将CH3CHOHCOOH发生消去得CH2=CHCOOH,然后再用CH2=CHCOOH与水加成得HOCH2CH2COOH,据此答题.
,以CH3CHO为原料制备HOCH2CH2COOH,可以将CH3CHO发生信息Ⅰ中的反应生成CH3CHOHCOOH,再将CH3CHOHCOOH发生消去得CH2=CHCOOH,然后再用CH2=CHCOOH与水加成得HOCH2CH2COOH,据此答题.
解答 解:(1)根据上面的分析可知,B为 ,化学名称 是苯乙醛,D为
,化学名称 是苯乙醛,D为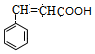 ,D中含氧官能团的结构简式为-COOH,
,D中含氧官能团的结构简式为-COOH,
故答案为:苯乙醛;-COOH;
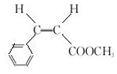
(2)E为 ,顺式-E的结构简式为
,顺式-E的结构简式为  ,
, →F的反应类型为 取代 反应,
→F的反应类型为 取代 反应,
故答案为: ;取代 反应;
;取代 反应;
(3)N→H的化学方程式为 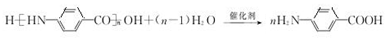 ,故答案为:
,故答案为: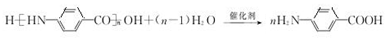 ;
;
(4)G为 ,G的含有相同官能团的所有芳香族化合物的结构简式为
,G的含有相同官能团的所有芳香族化合物的结构简式为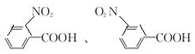 ,
,
故答案为: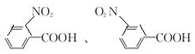 ;
;
(5)以CH3CHO为原料制备HOCH2CH2COOH,可以将CH3CHO发生信息Ⅰ中的反应生成CH3CHOHCOOH,再将CH3CHOHCOOH发生消去得CH2=CHCOOH,然后再用CH2=CHCOOH与水加成得HOCH2CH2COOH,合成路线为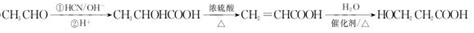 ,
,
故答案为: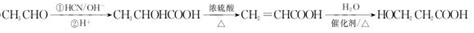 .
.
点评 本题考查有机物合成,题目难度中等,根据物质结构简式变化确定反应类型、反应条件,明确物质结构和性质关系是解本题关键,难点是有机物合成路线设计,可以根据目标产物采用倒推方法确定反应物,从而确定合适的合成路线,试题侧重考查学生分析、推断能力.


科目:高中化学 来源: 题型:选择题
| A. | 只有①③⑦ | B. | 除①⑧外 | C. | 除⑥外 | D. | 只有②⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Cl>Na>O>N | B. | 碱性:NaOH<Mg(OH)2<Al(OH)3 | ||
| C. | 熔点:CBr4>CCl4>CF4 | D. | 热稳定性:HF>HCl>H2S>H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若使电解质溶液恢复到电解前的浓度可向溶液中加入9.8×(10-b-10一a)g Cu(OH)2 | |
| B. | b<a<7 | |
| C. | 阳极产生的气体是O2,其体积(标准状况下)为:1.12×(10-b-10-a)L | |
| D. | 阴极电极反应式为:Cu2++2e-=Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 3O2(g)=2O3(g)△H=+242.4kJ•mol-1 | |
| B. | 氧气比臭氧稳定,大气中臭氧层易被破坏 | |
| C. | 断裂l mol O2(g)中的共价键吸收的能量比形成1 molCO2(g)中的共价键放出的能量少 | |
| D. | 相同物质的量的氧气比臭氧所含的能量高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①中硝酸铵既是氧化剂又是还原剂,H2O是氧化产物 | |
| B. | 反应②中K2SO3是还原剂,N2O是氧化产物 | |
| C. | 反应③中每生成1 mol N2O,转移8 mol电子 | |
| D. | 反应④中NaNO3是还原剂,N2O既是氧化产物又是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示,若电解5min时铜电极质量 增加2.16g,试回答:
如图所示,若电解5min时铜电极质量 增加2.16g,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.5×10-4m mol | B. | 5.0×10-4m mol | C. | 7.5×10-4m mol | D. | 1×10-3m mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com