
【题目】下列微粒中,只有还原性的是( )
A. Br﹣ B. S C. Mg2+ D. H2O
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】下列电离方程式正确的是
A. KClO3═K++Cl﹣+3O2﹣ B. Ba(OH)2 = Ba2+ +(OH)2-
C. Na2SO4 =2Na+ + SO4-2 D. HNO3 =H+ + NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝和铁是生活中常见的两种金属。
(1)加热铝箔,铝融化但不滴落,原因是_________________________________________;用铝箔包住金属钠,用针在铝箔上刺些小孔,用镊子夹住放入水中,可能发生的反应用化学方程式表示为: ___________________________和__________________________________铝与盐酸反应的离子方程式为:__________________________________。
(2)在高温下,Fe与水蒸气可发生反应。应用下图装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。请回答该实验中的问题。
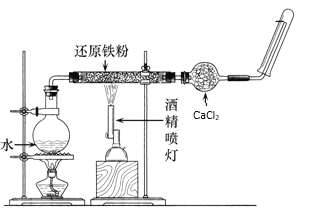
①写出该反应的反应方程式并用双线桥标出电子转转移方向和数目:______________________
②烧瓶底部放置了几片碎瓷片,碎瓷片的作用是________________________。
③酒精灯和酒精喷灯首先点燃的是__________________________。
④现欲将5.6 gFe完全溶解在稀硫酸中,加水后得200 mL溶液:所得硫酸亚铁溶液的物质的量浓度______________反应中转移的电子数是_________,生成的气体在标准状况下的体积是______________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx是造成大气污染的主要物质,用还原法将其转化为无污染的物质,对于消除环境污染有重要意义。
(1)已知:2C(s)+O2(g)![]() 2CO(g) △H1= -221.0 kJ/mol
2CO(g) △H1= -221.0 kJ/mol
N2(g)+O2(g)![]() 2NO (g) △H2= +180.5 kJ/mol
2NO (g) △H2= +180.5 kJ/mol
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H3= -746.0 kJ/mol
2CO2(g)+N2(g) △H3= -746.0 kJ/mol
回答下列问题:
①用焦炭还原NO生成无污染气体的热化学方程式为_______。
②在一定温度下,向甲、乙、丙三个恒容密闭容器中加入一定量的NO和足量的焦炭,反应过程中测得各容器中c(NO)(mol/L)随时间(s)的变化如下表。
已知:三个容器的反应温度分别为T甲= 400℃、T乙= 400℃、T丙= a ℃
时间 | 0 s | 10 s | 20 s | 30 s | 40 s |
甲 | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙 | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
丙 | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
甲容器中,该反应的平衡常数K=_______。丙容器的反应温度a _______400℃(填“”、“<”或“=”),理由是_______。
(2)用NH3催化还原NOx消除氮氧化物的污染。
已知:8NH3(g)+6NO2(g)![]() 7N2(g) +12H2O(l) △H<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图所示。
7N2(g) +12H2O(l) △H<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图所示。

①在催化剂A的作用下,0~4 min的v(NH3) = _______。
②该反应活化能Ea(A)、Ea(B)、Ea(C)由大到小的顺序是_______,理由是_______。
③下列说法正确的是_______(填标号)。
a.使用催化剂A达平衡时,△H值更大
b.升高温度可使容器内气体颜色加深
c.单位时间内形成N-H键与O-H键的数目相等时,说明反应已经达到平衡
d.若在恒容绝热的密闭容器中反应,当平衡常数不变时,说明反应已经达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)用绿矾晶体配制硫酸亚铁溶液时需加入少量铁粉,其目的是____________________,若绿矾失去了部分结晶水,会导致配制的溶液浓度__________(偏大、偏小、无影响)。
(2)设计实验检验绿矾晶体是否变质,写出实验方案:_______________________;
(3)若要检验硫酸铁溶液中是否含有Fe2+, 最好选用________________。
A.KSCN溶液、氯水 B. 酸性KMnO4溶液 C. NaOH溶液 D. H2O2溶液
(4)为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(装置A)称重,记为m 1 g。将样品装入石英玻璃管中,再次将装置A称重,记为m 2 g。按下图连接好装置进行实验。
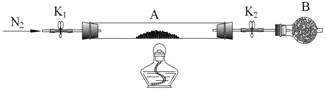
①仪器B的名称是____________________。
②用N2排净装置中的空气,加热装置A,使其彻底失去结晶水直至A恒重,记为m3 g。
③根据实验记录,计算绿矾化学式中结晶水数目x=________________(列式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是2SO3(g) 2SO2(g) + O2(g) 的能量变化图,据图得出的相关叙述正确的是
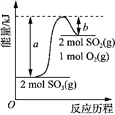
A. 2SO3(g) 2SO2(g) + O2(g) + (a-b) kJ
B. 1mol SO2的能量比1mol SO3的能量高
C. 若有2mol SO3充分反应,吸收(a-b) kJ热量
D. 该化学反应过程中的能量变化既有吸热又有放热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料显示:久置于潮湿环境中的漂白粉受热生成O2和少量Cl2;干燥的漂白粉加热后发生反应Ca(ClO)2![]() CaCl2 + O2↑。
CaCl2 + O2↑。
学生甲利用下图装置进行实验:加热A中试管内装有的潮湿漂白粉样品时,观察到B中有大量气泡产生。
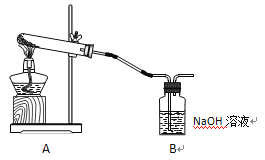
(1)B中发生反应的离子方程式为__________________________________________________。
(2)请写出实验室检验氯气的方法:_____________________________________________。
学生乙设计实验测定某干燥漂白粉样品中次氯酸钙的百分含量。实验步骤如下:
①称量坩埚的质量,为W1g。
②坩埚中加入样品后再称,质量为W2g。
③重复进行加热、冷却、称量,直到恒重,质量为W3g。
(3)称量所用仪器名称为_____________________;实验到达恒重的判断依据是___________________________________________________。
(4)该漂白粉样品中次氯酸钙的百分含量为_________________(用W1、W2、W3表示);若所用坩埚内壁沾有受热易分解的物质,则该实验测得的结果__________________。(选填“偏大”、“偏小”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是一种在涂料、玻璃等领域应用非常广泛的红色氧化物。它不溶于水和醇,溶于盐酸、氯化铵、氨水,易被O2、 硝酸等氧化。一种以硫化铜矿石(含CuFeS2、Cu2S 等) 为原料制取Cu2O 的工艺流程如下:
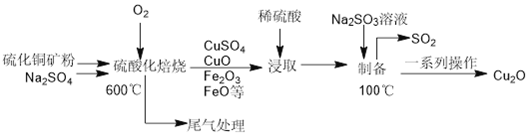
(1) “硫酸化焙烧”时:CuS 与O2反应生成CuSO4等物质的化学方程式为________________;在100℃时,发生反应的离子方程式为________________________________。
(2)加入Na2SO4的作用除减小物料间黏结外,另一主要作用是_____________________。
(3) “浸取”时为提高铜的浸取率,除需控制液固物质的量之比外,还需控制________________ (至少列举两点)。
(4)得到产品Cu2O的一系列操作主要是___________________________________。
(5)下列有关说法正确的是______________
A.焙烧时得到的尾气可用碱液加以处理
B.Cu2O露置至于空气中会变黑
C.经一系列操作得到产品Cu2O后的副产品,经处理后可作净水剂
D.“制备”时,溶液的pH越小,Cu2O 的产率越高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com