
| A. | 甲基电子式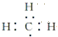 | B. | 四氯化碳比例模型 | ||
| C. | 甲酸甲酯分子式C2H4O2 | D. | 34S2-结构示意图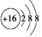 |
分析 A.甲基为中性原子团,C原子最外层电子数为7;
B.四氯化碳分子中,氯原子的相对体积大于C原子;
C.甲酸甲酯为甲酸与甲醇通过酯化反应生成的酯;
D.硫离子的核电荷数为16,核外电子总数为18,最外层满足8电子稳定结构.
解答 解:A.甲基中含有3个C-H键,为中性原子团,其电子式为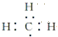 ,故A正确;
,故A正确;
B. 可以表示甲烷的比例模型,而四氯化碳分子中,氯原子的原子半径大于碳原子,四氯化碳的比例模型为
可以表示甲烷的比例模型,而四氯化碳分子中,氯原子的原子半径大于碳原子,四氯化碳的比例模型为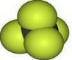 ,故B错误;
,故B错误;
C.甲酸甲酯分子中含有2个C、4个H和1个O原子,其分子式为:C2H4O2,故C正确;
D.硫离子的核外电子数为18,最外层满足8电子稳定结构,34S2-结构示意图为: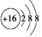 ,故D正确;
,故D正确;
故选B.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、比例模型、离子结构示意图、分子式等知识,明确常见化学用语的概念及书写原则为解答关键,B为易错点,注意掌握甲烷与四氯化碳的比例模型的区别.


 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
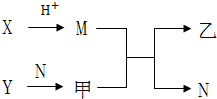 已知A、B、C、D为短周期内原子半径依次增大的元素,X、Y、M、N分别由这四种元素中的两种组成的常见化合物,甲、乙为其中两种元素对应的单质.若X与Y、甲与乙摩尔质量相同,Y与乙均为淡黄色固体,上述物质之间的转化关系如图所示(部分反应物或生成物省略),则下列说法中不正确的是( )
已知A、B、C、D为短周期内原子半径依次增大的元素,X、Y、M、N分别由这四种元素中的两种组成的常见化合物,甲、乙为其中两种元素对应的单质.若X与Y、甲与乙摩尔质量相同,Y与乙均为淡黄色固体,上述物质之间的转化关系如图所示(部分反应物或生成物省略),则下列说法中不正确的是( )| A. | A、C、D的常见氧化物相互之间一定能反应 | |
| B. | 相对分子质量M>N,沸点N>M | |
| C. | 简单离子半径:C2->B2->D+>A+ | |
| D. | D与其他元素均能形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子层数多的原子的半径一定大于电子层数少的原子的半径 | |
| B. | P4S3分子中各原子的最外层均已达到了8电子稳定结构,则分子中共价键数目为9条 | |
| C. | H2SO3酸性强于H2CO3,所以非金属性S大于C | |
| D. | 不同原子形成的化合物中一定只含极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-═Ag++NO↑+H2O | |
| C. | Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | 明矾溶于水产生Al(OH)3胶体:Al3++3H2O═Al(OH)3↓+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水与少量NaHCO3溶液反应 | |
| B. | 澄清石灰水与过量NaHCO3溶液反应 | |
| C. | Ca(HCO3)2溶液与过量NaOH溶液反应 | |
| D. | 澄清石灰水与过量Ca(HCO3)2溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3胶体的制备:Fe3++3NH3•H2O═Fe(OH)3(胶体)+3NH4+ | |
| B. | 等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| C. | 铅酸蓄电池充电时的阳极反应:PbSO4+2H2O-2e-═PbO2+4H++SO42- | |
| D. | 用过量氨水吸收工业尾气中的SO2:NH3•H2O+SO2═NH4++HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com