
【题目】对某酸性溶液(可能含有Br﹣ , SO42﹣ , H2SO3 , NH4+)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色;
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸.
对于下列物质不能确认其在原溶液中是否存在的是( )
A.Br﹣
B.SO42﹣
C.H2SO3
D.NH4+
【答案】B
【解析】解:①加热时放出的气体可以使品红溶液褪色,说明生成二氧化硫气体,说明溶液中含有H2SO3;
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;证明气体是NH3 , 原溶液含有NH4+;
③加入氯水时,溶液略显黄色,证明溶液中含有Br﹣ , 再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸,说明生成硫酸钡沉淀,但在硝酸溶液中亚硫酸可以被氧化为硫酸和氯化钡反应生成硫酸钡沉淀,不能确定原溶液中 是否含有硫酸根离子;
综上所述:根据实验①可知含有H2SO3 , 根据实验②确定含有 ![]() ,据实验③可推知有Br﹣ , 不能确定有无
,据实验③可推知有Br﹣ , 不能确定有无 ![]() ,因H2SO3被氯水氧化成H2SO4 .
,因H2SO3被氯水氧化成H2SO4 .
故选B.
①加热时放出的气体可以使品红溶液褪色,说明生成二氧化硫气体,说明溶液中含有H2SO3;
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;证明气体是NH3 , 原溶液含有NH4+;
③加入氯水时,溶液略显黄色,证明溶液中含有Br﹣ , 再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸,说明生成硫酸钡沉淀,但在硝酸溶液中亚硫酸可以被氧化为硫酸和氯化钡反应生成硫酸钡沉淀,不能确定原溶液中 是否含有硫酸根离子;


科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E原子序数依次增大。已知:A、C同主族,A的原子最外层电子数是次外层的3倍,B的氧化物既能溶于强酸,又能溶于强碱,D的原子半径是第3周期中最小的,E是形成骨骼和牙齿的主要元素,且E单质能和水反应。则下列分析错误的是
A. A的离子结构示意图为![]()
B. D的最高价氧化物的水化物的酸性大于C的最高价氧化物的水化物的酸性
C. E和D形成的离子化合物ED2的电子式为![]()
D. B的氧化物为离子化合物,只含离子键,其晶体为离子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学做了如下实验:
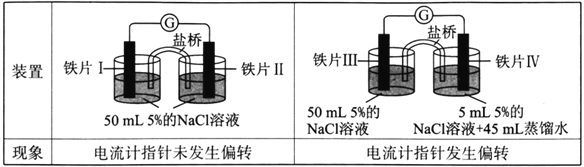
下列说法中正确的是
A. 加热铁片I所在烧杯,电流表指针会发生偏转
B. 用KSCN溶液检验铁片Ⅲ、IV附近溶液,可判断电池的正、负极
C. 铁片I、Ⅲ的腐蚀速率相等
D. “电流计指针未发生偏转”,说明铁片I、铁片Ⅱ均未被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,分子的一端亲水,另一端亲油的是( )
A.CH3(CH2)15SO3Na
B.CH2CH2CH3
C.CCl4
D.CH3(CH2)4CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答问题:
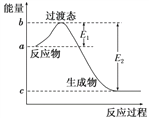
(1)如图是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是________(填“增大”“减小”或“不变”,下同),ΔH的变化是________。
(2)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为__________。
(3)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g)===H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸气燃烧为液态水的热化学方程式为____________________________________________________________________。
(4)在微生物作用的条件下,NH经过两步反应被氧化成NO。这两步的能量变化如图:
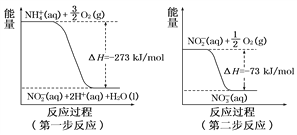
第二步反应是__________反应(填“放热”或“吸热”)。1 mol NH(aq)全部氧化成NO(aq)的热化学方程式是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验误差分析错误的是
A. 用湿润的pH试纸测稀碱液的pH,测定值偏小
B. 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C. 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D. 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铈(58Ce)常用于制作稀土磁性材料,可应用于制造玻璃、打火石、陶瓷和合金等。已知:Ce4++Fe2+=Ce3+ +Fe3+。下列说法正确的是
A. 可用电解熔融CeO2制取金属铈,铈在阳极生成
B. ![]() 、
、![]() 是同素异形体
是同素异形体
C. 铈的原子核外有58个电子
D. 铈能溶于HI溶液,发生反应的离子方程式为:Ce+4H+=Ce4++2H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保护环境是我国的一项基本国策,下列做法不应该提倡的是( )
A.出门尽可能步行骑行或坐公交B.深入农村和社区进行环保宣传
C.吃快餐时尽量不要用塑料袋D.用过的废旧电池埋到田地里。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com