
【题目】在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液(含有Fe2+、Fe3+、Cu2+)处理和资源回收很有意义。某兴趣小组设计了如下处理方案。
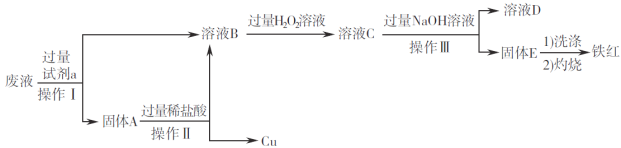
回答下列问题:
(1)固体A的成分是______________(填化学式)。
(2)由溶液B生成溶液C的离子方程式为___________________;检验溶液C中金属阳离子的试剂是____(填名称)。
(3)检验固体E是否洗涤干净的操作为____________________________;灼烧时,用于盛放固体E的仪器为____________________________(填名称)。
(4)铁红用途广泛,可用于焊接钢轨,写出该反应的化学方程式___________________________。
【答案】 Fe、Cu 2Fe2++H2O2+2H+=2Fe3++2H2O 硫氰化钾 取最后一次洗涤液少许于试管中,加硝酸酸化的硝酸银溶液,若无沉淀生成,则洗涤干净;若有沉淀生成,则未洗涤干净 坩埚 2Al+Fe2O3![]() 2Fe+Al2O3
2Fe+Al2O3
【解析】分析:废液中含有Fe2+、Fe3+、Cu2+,废液中加入过量铁屑后发生反应:Fe+2Fe3+=3Fe2+、Fe+Cu2+=Fe2++Cu;过滤后得到的沉淀A为Fe、Cu;滤液中含有Fe2+,滤液中加入过量的H2O2,Fe2+被氧化为Fe3+;沉淀A与过量盐酸反应,Fe与盐酸反应生成氯化亚铁,而铜不反应,溶液C与过量NaOH溶液反应生成Fe(OH)3沉淀,E为Fe(OH)3,据此进行解答。
详解: 废液中含有Fe2+、Fe3+、Cu2+,废液中加入过量铁屑后发生反应:Fe+2Fe3+=3Fe2+、Fe+Cu2+=Fe2++Cu;过滤后得到的沉淀A为Fe、Cu;滤液中含有Fe2+,滤液中加入过量的H2O2,Fe2+被氧化为Fe3+;沉淀A与过量盐酸反应,Fe与盐酸反应生成氯化亚铁,而铜不反应,
(1)根据分析可以知道,沉淀A含有的单质为Fe、Cu,
因此,本题正确答案是:Fe、Cu;
(2) 溶液B中亚铁离子与H2O2反应生成铁离子,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,检验溶液Fe3+的试剂是硫氰化钾
因此,本题正确答案是:2Fe2++H2O2+2H+=2Fe3++2H2O;硫氰化钾;
(3)根据反应过程分析,若Fe(OH)3沉淀没有洗涤干净,表面会含有Cl-,所以检验Fe(OH)3沉淀是否洗涤干净的操作为:取最后一次洗涤液少许于试管中,加硝酸酸化的硝酸银溶液,若无沉淀生成,则洗涤干净;若有沉淀生成,则未洗涤干净;
灼烧氢氧化铁要用坩埚;
因此,本题正确答案是:取最后一次洗涤液少许于试管中,加硝酸酸化的硝酸银溶液,若无沉淀生成,则洗涤干净;若有沉淀生成,则未洗涤干净;坩埚;
(4)铁红发生铝热反应焊接铁轨,反应的化学方程式为:2Al+Fe2O3![]() 2Fe+Al2O3,
2Fe+Al2O3,
因此,本题正确答案是:2Al+Fe2O3![]() 2Fe+Al2O3。
2Fe+Al2O3。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定.回答下列问题:
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5molL﹣1盐酸、0.55molL﹣1NaOH溶液,实验尚缺少的玻璃用品是 .
(2)已知:反应后溶液的比热容c为4.18J℃﹣1g﹣1 , 0.5molL﹣1盐酸和0.55molL﹣1NaOH溶液的密度均为1gcm﹣3 . 实验时记录的实验数据如表:
实验 | 反应物及用量 | 溶 液 温 度 | ||
t1 | t2 | |||
1 | 50mL0.55molL﹣1NaOH溶液 | 50mL.0.5molL﹣1HCl溶液 | 20℃ | 23.3℃ |
2 | 50mL0.55molL﹣1NaOH溶液 | 50mL.0.5molL﹣1HCl溶液 | 20℃ | 23.5℃ |
①盐酸和氢氧化钠反应的中和热△H1=(保留两位小数)
②已知:CH3COOH(aq)CH3COO﹣(aq)+H+(aq)△H2>0,
CH3COOH(aq)+OH﹣(aq)=CH3COO﹣(aq)+H20(l)△H3 则△H3△H1(填“>”、“<”、“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,七种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答:
(1)x在元索周期表的位置是________________________。
(2)y的最高价氧化物对应的水化物与其氢化物反应,产物中含有化学键的类型为________________。
(3)d的单质在空气中充分燃烧,所得产物的电子式为________;7.8g该产物与足量的水完全反应,转移电子的数目为____________________。
(4)z、e、f的简单离子半径由大到小的顺序为_______________(用离子符号表示)。
(5)能说明g的非金属性比f强的实验事实是________________(列举一条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下列要求作答.
(1)宇宙中含量最高的元素为(填元素符号).
(2)第四周期中第一电离能最小的元素的最高价氧化物的水化物的电子式为 .
(3)电负性最大的元素的原子核外电子排布式为 .
(4)第二周期中,第一电离能介于B和N之间的元素共有种.
(5)最外层电子排布为4s24p1的原子的核电荷数为
(6)前36号元素中,未成对电子数最多的元素在周期表中的位置为 , 它位于 区.
(7)地球上的元素绝大多数是金属,非金属 (包括稀有气体)仅应 种.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种重要的基本化工原料,其产量可以用来衡量一个国家的石道化工发展水平。E是具有香味的液体。转化关系如下图所示(部分反应条件产物省略):
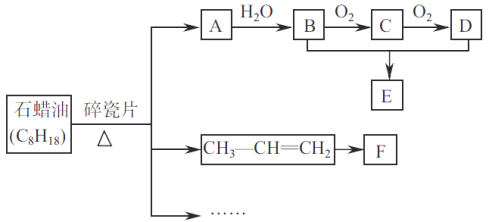
回答下列问题:
(1)A中所含官能团名称为_________________。由B和D生成E的化学方程式为________________。
(2)F为高分子化合物。可以用来制造汽车保险杠,其结构简式为__________________。
(3)设计实验证明A与溴水发生加成反应而不是取代反应__________________________。
(4)有机物X是石蜡油(C8H18)的同系物,分子中碳与氢的质量比为5:1,X的同分异构体共有____种,其中一氯代物只有一种的是__________(写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二胺(H2NCH2CH2NH2 )是二元弱碱,在水中的电离原理类似于氨。常温下,向乙二胺溶液中滴加稀盐酸,溶液的pH随离子浓度变化关系如图所示。下列叙述不正确的是

A. 常温下,pKb2=-1gKb2 =7.15
B. 溶液中水的电离程度:a点大于b点
C. H3NCH2CH2NH2Cl2 溶液中c(H+)>c(OH-)
D. 曲线G代表pH 与![]() 的变化关系
的变化关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镓(Ga)被誉为第三代半导体的明屋元素,广泛应用于电子工业。Ga位于周期表的第四周期,与A1同主族,主要存在Ga3+、GaO2-两种离子形态。
(1)请画出Ga的原子结构示意图___________。
(2)请写出Ga2O3溶解在NaOH溶液中的离子方程式_________________。
(3)氮化镓(GaN)可用于制作蓝色LED光源。GaN的传统工艺是用GaCl3与NH3反应来制备,新工艺则采用金属Ga与NH3在一定条件下来合成。已知:
①GaCl3(s)+NH3(g)=GaN(s)+3HCl(g) H1=+180kJ/mol
②2Ga(s)+6HCl(g)=2GaCl3(s)+3H2(g)H2=-492kJ/mol
③Ga(s)+NH3(g)=GaN(s)+3/2H2(g) H3
由上述反应可知H3=_____________。
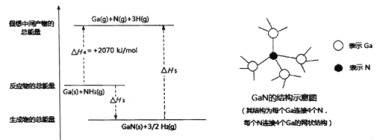
已知H-H的键能为436kJ/mol,结合上图分析,1molGaN含有_____molGa-N键,拆开lmolGa-N键所需能量为______kJ。
(4)工业上多用电解精炼法提纯镓。具体原理如下图所示:
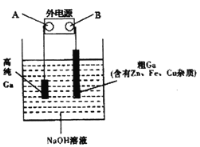
已知:金属的活动性Zn>Ga>Fe>Cu
①A为电源的_____极,电解精炼镓时产生阳极泥的主要成分是___________。
②电解过程中阳极产生的离子迁移到达阴极并在阴极放电析出高纯镓。请写出电解过程的阴极的电极反应_______________。
③电解过程中需控制合适的电压,若电压太高时阴极会产生H2导致电解效率下降。若外电路通过0.4mole-时,阴极得到7.0g的镓。则该电解装置的电解效率η=___________。(η=生成目标产物消耗的电子数÷转移的电子总数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保护环境已成为当前和未来的全球性的重大课题之一,下列因为人类生产对环境破坏而带来的后果是( )
①土地沙漠化 ②酸雨 ③水资源危机 ④南极上抽样空洞 ⑤沙尘暴.
A.①②⑤
B.①②④⑤
C.②⑤
D.①②③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com