
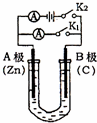
 如图所示,U形管内盛有100mL的溶液,请按要求回答下列回答.
如图所示,U形管内盛有100mL的溶液,请按要求回答下列回答.
| ||
| ||
| ||
| ||
| 1 |
| 0.001mol |
| 0.1L |


科目:高中化学 来源: 题型:
| 成分 | 质量(g) | 摩尔质量(g?mol-1) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 0.25 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 0.25 | 158 |
| 硝酸银 | 0.02 | 170 |
查看答案和解析>>
科目:高中化学 来源: 题型:
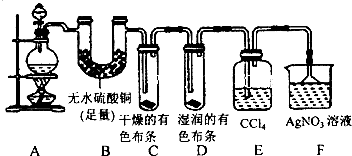
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
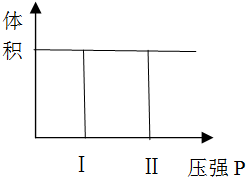

| t1-t2 | t2-t3 | t3-t4 | t4-t5 | t5-t6 |
| K1 | K2 | K3 | K4 | K5 |

查看答案和解析>>
科目:高中化学 来源: 题型:
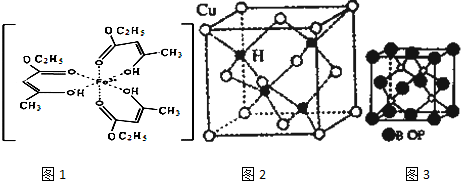
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用分液漏斗分离溴乙烷与氢氧化钠溶液发生反应后的生成物 |
| B、纤维素、合成纤维和光导纤维都是有机高分子化合物 |
| C、在蒸发皿中加热Na2CO3?10H2O使其脱水 |
| D、乙醇、乙烯、乙醛都能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com