
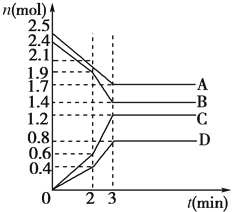
 在某一容积为2L的密闭容器中,A、B、C、D四种气体物质的量(n)随时间(t)的变化曲线如图所示:
在某一容积为2L的密闭容器中,A、B、C、D四种气体物质的量(n)随时间(t)的变化曲线如图所示:| 0.4mol |
| 2L?2min |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
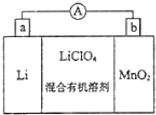 锰锂电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题:
锰锂电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
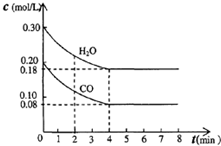 (1)氢能是高效、清洁能源,制氢技术的研究开发是氢能利用的必由之路.燃料水蒸气重整法是一种有效、经济、广泛采用的制氢方法,它是通过水蒸气与燃料间的反应来制取氢气的.①在催化剂作用下,天然气和水蒸气反应可制得一氧化碳和氢气,已知该反应每制得1kg氢气需要吸收3.44×104 kJ热量,请写出该反应的热化学式:
(1)氢能是高效、清洁能源,制氢技术的研究开发是氢能利用的必由之路.燃料水蒸气重整法是一种有效、经济、广泛采用的制氢方法,它是通过水蒸气与燃料间的反应来制取氢气的.①在催化剂作用下,天然气和水蒸气反应可制得一氧化碳和氢气,已知该反应每制得1kg氢气需要吸收3.44×104 kJ热量,请写出该反应的热化学式:查看答案和解析>>
科目:高中化学 来源: 题型:
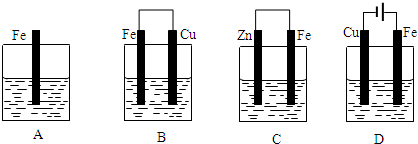
 该蓄电池结构和反应原理如图,其中放电时是一个
该蓄电池结构和反应原理如图,其中放电时是一个查看答案和解析>>
科目:高中化学 来源: 题型:
| A、严禁排放未经处理的有毒工业废水--防止水土流失 |
| B、限制生产、使用含磷洗涤剂--防止出现“臭氧空洞” |
| C、在新装修的室内摆放适宜的花卉--改善室内空气质量 |
| D、给汽车安装尾气净化装置--减少氮的氧化物及一氧化碳的排放 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com