
【题目】运用阿伏伽德罗定律及其推论,按要求填空:
(1)标准状况下,5L CH4气体与5L NH3气体的原子个数之比为______________;
(2)同温、同压下,不同体积的N2和CO气体密度之比为______________;
(3)同温、同压下,等质量的一氧化碳和二氧化碳的体积之比为______________;
(4)同温、同压下,等体积的N2和O2的质量比为________________
【答案】5:4 1:1 11:7 7:8
【解析】
根据阿佛加德罗定律及其推论计算。
(1)相同条件下的气体,体积之比等于物质的量之比,5L CH4气体与5L NH3气体的物质的量之比为1:1,根据分子结构特点,原子个数之比为5:4;
(2) N2和CO的摩尔质量均为28g/mol,同温、同压下,ρ=![]() =
=![]() =
=![]() ,则N2和CO气体密度之比等于摩尔质量之比,为1:1;
,则N2和CO气体密度之比等于摩尔质量之比,为1:1;
(3)同温、同压下,等质量的一氧化碳和二氧化碳的物质的量之比为n(CO):n(CO2)=![]() :
:![]() =44:28=11:7,体积之比等于物质的量之比,即11:7;
=44:28=11:7,体积之比等于物质的量之比,即11:7;
(4)同温、同压下,等体积的N2和O2的物质的量之比为1:1,则质量之比等于摩尔质量之比=28:32=7:8。


科目:高中化学 来源: 题型:
【题目】一种太阳能电池的工作原理如下图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液。下列说法不正确的是
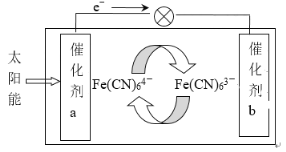
A.K+ 移向催化剂b
B.催化剂a表面发生的化学反应:Fe(CN)64--e-= Fe(CN)63-
C.Fe(CN)63- 在催化剂b表面被氧化
D.电解池溶液中的Fe(CN)64- 和Fe(CN)63- 浓度基本保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】线型PAA(![]() )具有高吸水性,网状PAA在抗压性、吸水性等方面优于线型PAA。网状PAA的制备方法是:将丙烯酸用NaOH中和,加入少量交联剂a,再引发聚合。其部分结构片段如下:
)具有高吸水性,网状PAA在抗压性、吸水性等方面优于线型PAA。网状PAA的制备方法是:将丙烯酸用NaOH中和,加入少量交联剂a,再引发聚合。其部分结构片段如下:
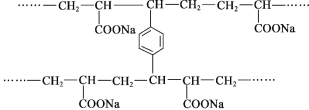
下列说法不正确的是( )
A. 线型PAA的单体不存在顺反异构现象
B. 交联剂a的结构简式是![]()
C. 形成网状结构的过程发生了加聚反应
D. PAA的高吸水性与—COONa有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 mol过氧化钠与2 mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是( )
A. Na2CO3 B. Na2O2、Na2CO3
C. NaOH、Na2CO3 D. Na2O2、NaOH、Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是重要的化工原料,在工农业生产和国防上有重要用途。
(1)实验室利用硝石(NaNO3)和浓硫酸共热制取硝酸。
①该反应利用了浓硫酸的_______性;
②该反应的温度不宜太高,原因是(用化学方程式表示)______;
(2)工业上用氨气的催化氧化法制取硝酸,再利用硝酸和氨气反应生产NH4NO3。
①写出氨气的电子式_____;
②写出氨气催化氧化的化学方程式_______;
③在生产过程中,氨催化氧化生成氮氧化物的利用率是80%,氮氧化物被吸收得到硝酸的利用率是85%,则制取80 t的NH4NO3需要氨气______t;
(3)某混合酸1L中含1mol的硝酸和2mol的硫酸。取该混合酸100mL,加入5.6g铁粉充分反应。
①反应中可以生成NO____L(标准状况);
②向反应后的溶液再加入铁粉,能继续溶解铁粉____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴元素由于其良好的物理化学性质,被广泛应用于生产生活中。从含钴废料(含CoO、Co2O3、单质Al、Li等)中制取粗CoCl2·6H2O的流程如下所示。
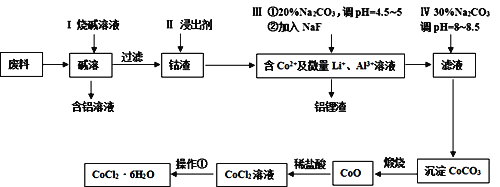
请回答下列问题:
(1)步骤I中主要发生的化学反应方程式为______。
(2)已知Co2O3具有强氧化性,若步骤II中浸出剂为盐酸,造成的后果是_______。
(3)步骤Ⅲ中①的目的是除去Al3+,写出该步反应的离子方程式______。
(4)若在实验室煅烧CoCO3,所需的硅酸盐质仪器除酒精灯和玻璃棒外,还有______、______(填仪器名称)。
(5)操作①是在HCl氛围中进行的,其步骤是______、_____、过滤、洗涤、干燥。洗涤过程中可以用工业酒精代替水,其优点是_____。
(6)某同学用标准硝酸银溶液滴定未知浓度的CoCl2溶液,下列可作为指示剂的是____(填选项,忽略亚钴离子的颜色干扰)
A.KCl B.KSCN C.K2CrO4 D.K2S
已知几种物质在20℃时的颜色及Ksp值如下表
化学式 | AgCl | AgSCN | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 黑色 | 红色 |
Ksp | 2.0×10-10 | 1.0×10-12 | 2.0×10-48 | 2.0×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,气体反应物既被氧化又被还原的是
A.金属钠露置在空气中迅速变暗
B.露置在空气中的过氧化钠固体变白
C.将氨气与氯化氢混合,产生大量白烟
D.充满二氧化氮的试管倒扣在水槽中,试管内液面上升
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】36.5gHCl溶解在1L水中(水的密度近似为1 gmL-1),所得溶液的密度为ρ gmL-1,质量分数为w,物质的量浓度为c gmL-1,NA表示阿伏加德罗常数,下列说法正确的是( )
A.所得溶液的物质的量浓度:c=1 gmL-1
B.所得溶液中含有NA个HCl分子
C.36.5 gHCl气体占有的体积为22.4L
D.所得溶液的质量分数: w=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁与稀硝酸的反应为:Mg+ HNO3(稀)—— Mg(NO3)2+ NO↑+ H2O
(1)配平上述化学方程式并用“双线桥法”表示该反应中电子转移的方向和数目。________
(2)该反应中,还原产物是_________,HNO3表现了______________(选填“还原性”、“氧化性”、“酸性”、“碱性”)。
(3)若反应过程中转移的电子为0.6 mol,则被还原的硝酸物质的量为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com