
【题目】常温下,向 100 mL0.01 mol·L-1HA 溶液中逐滴加入0.02 mol·L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。下列叙述一定正确的是
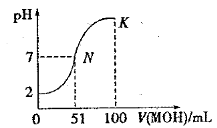
A.由图中信息可知HA为弱酸
B.在N点pH=7,酸碱恰好完全反应
C.常温时一定浓度的MA稀溶液显中性
D.K 点对应的溶液中,c(M+) + c(MOH)=2c (A-)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图的各方框表示一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。

(1)写出物质X的化学式:__。
(2)写出下列变化的化学方程式:
①A→D:___;
②G→E:___;
③F→G:___。
(3)实验室里,常用加热固体混合物的方法制取气体C,请写出化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示渗透作用装置图,其中半透膜为膀胱膜,甲、丙装置中A、B、a、b溶液浓度分别用MA、MB、Ma、Mb表示,乙、丁装置分别表示一段时间后甲、丙装置的状态,液面上升的高度分别为h1、h2。如果A、B、a、b均为蔗糖溶液,且MA>MB,Ma=Mb>MA,则达到平衡后( )
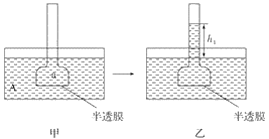
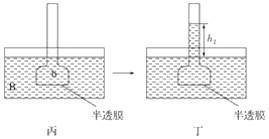
A. h1>h2、Ma>MbB. h1>h2、Ma<Mb
C. h1<h2、Ma<MbD. h1<h2、Ma>Mb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z为短周期原子序数依次增大的主族元素,其原子序数之和为30,W与X、Y、Z都能形成共价化合物,Y、W形成的常见化合物溶于水显碱性,Z、W形成的化合物溶于水显酸性,四种元素形成的某种化合物的结构式为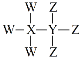 。下列说法错误的是
。下列说法错误的是
A.X为硼元素或碳元素
B.Y不属于第ⅣA族元素
C.W与Y、Z分别形成的常见化合物能反应生成盐
D.最高价氧化物对应的水化物的酸性:Z>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了某短周期元素R的各级电离能数据(用I1、I2……表示,单位为kJ·mol-1)

下列关于元素R的判断中一定正确的是( )
A. R的最高正价为+3价
B. R元素位于元素周期表中第ⅡA族
C. R元素的原子最外层共有4个电子
D. R元素基态原子的电子排布式为1s22s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁晶体([CH3CH(OH)COO]2Fe·3H2O,Mr=288) 可由乳酸与FeCO3反应制得,它易溶于水,是一种很好的补铁剂。
Ⅰ.制备碳酸亚铁(装置如图所示)

(1)仪器A的名称是______________ ;
(2)实验操作如下:关闭活塞2,打开活塞1、3,加入适量稀硫酸反应一段时间,其目的是___________________________________________________________;然后关闭活塞1,接下来的操作是_______________; 装置C中发生反应的离子方程式为______________ 。
Ⅱ.制备乳酸亚铁
向纯净的FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应。
(3)为防止乳酸亚铁变质,在上述体系中还应加入____________________________________________________________________________
(4)为证明乳酸亚铁中含有Fe2+,选择的检验试剂为_______________________________________________________________________;
Ⅲ. 乳酸亚铁晶体纯度的测量
经过过滤、隔绝空气低温蒸发、冷却结晶、过滤、洗涤、干燥等操作,获得乳酸亚铁晶体后
(5)两位同学分别用不同的方案进行测定:
①甲同学通过KMnO4滴定法测定样品中Fe2+的含量计算样品纯度,所得纯度总是大于100%,其原因可能是_________________________________________________________________________________________________________________
②乙同学经查阅文献后改用(NH4)4Ce(SO4)4滴定法测定样品中Fe2+的含量计算样品纯度(反应中Ce4+被还原为Ce3+),称取6.00g样品配成250.00mL溶液,取25mL,用0.1 molL—1(NH4)4Ce(SO4)4标准溶液滴定至终点,消耗标准液20.00mL。则产品中乳酸亚铁晶体的纯度为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu3N具有良好的电学和光学性能,在电子工业领城、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的作用。
(1)Cu+的核外电子排布式为__________;N元素与O元素的第一电离能比较:N____O(填“>”、“<”或“=”)。
(2)与N3-含有相同电子数的四原子分子的空间构型为____________________。
(3)在Cu催化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中醛其(![]() )碳原子的杂化方式为_________。
)碳原子的杂化方式为_________。
(4)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被C1-取代可生成Cu(H2O)2Cl2,试画出其具有极性的分子的结构式________________。
(5)Cu3N的晶胞结构如图所示,N3-的配位数为________;若晶胞棱长为anm,NA表示阿伏加德罗常数的值,则Cu3N的密度p=______g/cm3 [用含a 和NA 的式子表示,Mr(Cu3N)=206]
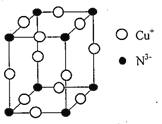
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茶叶中含有多种有益于人体健康的有机成分及钙、铁等微量金属元素,某化学研究性学习小组设计方案用以检验某品牌茶叶中铁元素的存在并测定钙元素的质量分数(已知CaC2O4为白色沉淀物质)。首先取200g茶叶样品进行如图操作:
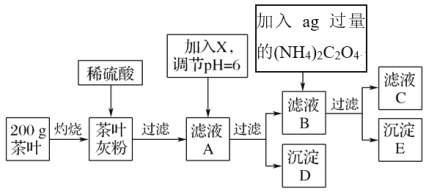
已知:①文献资料显示:某些金属离子的氢氧化物完全沉淀时的pH为:Ca(OH)2:13,Fe(OH)3:4.1
②(NH4)2C2O4溶液显酸性。
(1)实验前要先将茶叶样品高温灼烧为灰粉,需要用到的实验仪器有酒精灯、三脚架、玻璃棒、泥三角________,其主要目的是___________________。
A.蒸发皿 B.坩埚C.石棉网
(2)从滤液A→沉淀D的过程中需要加入的物质X可以选择________。
A.CaO B.Ca(OH)2C.NH3·H2O
(3)用酸性KMnO4标准溶液滴定滤液C时发生的反应为:5C2O42-+2MnO4-+16H+===10CO2↑+2Mn2++8H2O。将滤液C稀释至250mL,取25.00mL溶液,用硫酸酸化后,用0.10mol·L-1的KMnO4标准溶液滴定,终点时消耗KMnO4溶液体积如表所示:
编号 | KMnO4溶液体积/mL |
1 | 19.98 |
2 | 22.00 |
3 | 20.02 |
①此步操作过程中需要用到图示中哪些仪器________
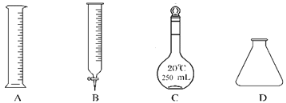
②滴定达到终点时的现象是__________________________。
③为保证实验精确度,沉淀D及E需要分别洗涤,并将洗涤液转移回母液中,若不洗涤沉淀D,会使测定的钙元素的含量________(偏低、偏高、无影响,下同),若不洗涤沉淀E,会使测定的钙元素的含量________。
④原茶叶中钙元素的质量分数为________。(用含a的代数式表示,已知(NH4)2C2O4的摩尔质量为124g·mol-1)。
(4)可以通过检验滤液A来验证该品牌茶叶中是否含有铁元素,所加试剂及实验现象是_______________、________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一瓶气体为NH3,气体的物质的量为0.2mol。
①气体的质量为______,气体中含氢原子的物质的量为____ mol。
②气体中所含分子数为_____。
③气体在标准状况下的体积为______。
④将气体甲完全溶解于水中形成500mL溶液,所得溶液溶质的物质的量浓度为______ molL-1。
⑤将④中所得溶液取出100mL,加水稀释至1000ml,所得溶液溶质的物质的量浓度为 ______ molL-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com